
【题目】甲、乙、丙三种物质之间有如下转化关系:
甲![]() 乙
乙![]() 丙
丙![]() 甲
甲
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是_________(写化学式,下同)。写出“乙![]() 丙”转化的离子方程式:______________________。
丙”转化的离子方程式:______________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________。写出“甲![]() 乙”转化的离子方程式:_________________。
乙”转化的离子方程式:_________________。
【答案】Al2O3 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Fe2O3 Fe2O3+6H+=2Fe3++3H2O
【解析】
(1)甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则其为铝的化合物,与硫酸反应生成硫酸铝,与氨水反应生成的丙为Al(OH)3和硫酸铵,分解生成的甲为Al2O3。
(2)乙溶液中加入KSCN溶液,有红色出现,则乙为Fe2(SO4)3,与氨水反应生成的丙为Fe(OH)3和硫酸铵,分解产物甲为Fe2O3。
(1)据甲的性质及相关转化可知,甲为Al2O3,乙为Al2(SO4)3,丙为Al(OH)3。
则甲是Al2O3。“乙![]() 丙”转化的离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。答案为:Al2O3;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
丙”转化的离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3NH4+。答案为:Al2O3;Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(2)据乙溶液的性质及相关转化可知,甲为Fe2O3,乙为Fe2(SO4)3,丙为Fe(OH)3。
则甲物质是Fe2O3。写出“甲![]() 乙”转化的离子方程式:Fe2O3+6H+=2Fe3++3H2O。答案为:Fe2O3;Fe2O3+6H+=2Fe3++3H2O。
乙”转化的离子方程式:Fe2O3+6H+=2Fe3++3H2O。答案为:Fe2O3;Fe2O3+6H+=2Fe3++3H2O。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的性质说法正确的是
A. 溶解度:Na2CO3>NaHCO3
B. 右图所示装置可证明稳定性:Na2CO3>NaHCO3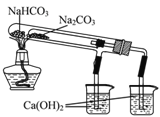
C. 用澄清石灰水可鉴别Na2CO3溶液和NaHCO3溶液
D. 等质量的Na2CO3和NaHCO3分别与过量盐酸反应,放CO2质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池是新型的绿色能源电池,其简化的生产工艺流程如下。
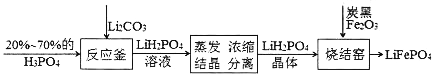
(1)反应釜中反应的化学方程式为_______,该反应体现出非金属性关系:P_____C(填“>”或“<”)。
(2)室温下,LiH2PO4溶液的pH随c(H2PO4-)的变化如图1所示,H3PO4溶液中H2PO4-的分布分数![]() 随pH的变化如图2所示[
随pH的变化如图2所示[![]() (含P元素的粒子)]。
(含P元素的粒子)]。
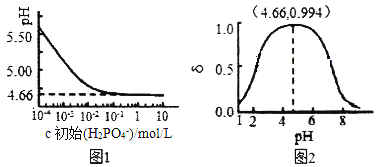
①由图1知,低浓度时LiH2PO4溶液的pH小于7,且随着c初始(H2PO4-)的增大而减小,其合理的解释为__________________。
②综合上图分析,若用浓度大于1mol/L的H3PO4溶液溶解Li2CO3,要使反应釜中的H3PO4几乎全部转化成LiH2PO4,反应釜中需要控制溶液的pH=________。
(3)磷酸铁锂电池总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向______(填“阳极”或“阴极”);放电时,正极反应式为__________________。
(4)磷酸铁锂电池中铁的含量可通过如下方法测定:称取1.60g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030mol/L重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液50.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是____________。
②铁的百分含量Fe(%)=_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收Cu并制备ZnO的部分实验过程如图所示:
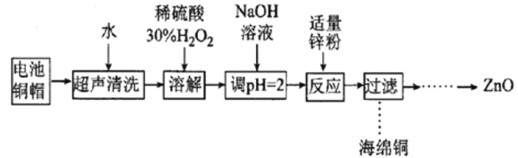
下列叙述错误的是
A. 合理处理废弃旧电池的铜帽既有利于节约资源,又有利于保护环境
B. “溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
C. 加入锌粉反应的离子为Cu2+
D. “过滤”操作后直接将溶液蒸发结晶、高温灼烧得到ZnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________。此方案第一步的实验装置如图所示:
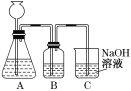
(2)加入反应物前,如何检验整个装置的气密性:___________。
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是___________,作用是:_________。
(4)在实验室通常制法中,装置A还可作为下列_________(填序号)气体的发生装置。
①HCl ②H2 ③Cl2
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_____mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)在150℃时2L的密闭容器中,将2molCH4和2molH2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=__。
②在该温度下,计算该反应的平衡常数K=__。
③下列选项中能表示该反应已达到平衡状态的是__。
A.v(H2)逆=3v(CO)正
B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变
D.C(CH4)=C(CO)
(2)合成气制甲醚的反应方程式为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H=bkJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如图所示。
CH3OCH3(g)+H2O(g) △H=bkJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如图所示。
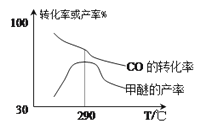
①290℃前,CO转化率和甲醚产率的变化趋势不一致的原因是__;
②b__0,(填“>”或“<”或“=”)理由是__。
(3)合成气中的氢气也用于合成氨气:N2+3H2![]() 2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是__;
2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是__;
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
容器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2mol | φ丙 | ν丙 | P丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)![]() cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如图所示(T2>T1),下列叙述正确的是( )
cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如图所示(T2>T1),下列叙述正确的是( )

A.达到平衡后,若使用催化剂,C的体积分数增大
B.达到平衡后,若使温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>c+f
D.达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:

下列说法正确的是
A. 粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B. 电解时用粗银作阴极,硝酸银溶液为电解质溶液
C. 用稀硫酸处理渣料时主要发生了氧化还原反应
D. 从滤液B中可以提取绿矾(FeSO4·7H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4nH2O)是一种重要的食品和饲料添加剂。在实验室里可以通过下列流程用废铁屑制备。
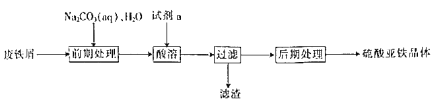
(1)试剂a是___(填写名称),上述流程中涉及的物质主要有①Na2CO3(aq)、②H2O、③试剂a、④废铁屑、⑤FeSO4nH2O,其中属于电解质的是___(填化学式),酸溶时发生的主要反应的化学方程式为___。
(2)上述流程中过滤操作所用的玻璃仪器有玻璃棒__、烧杯。
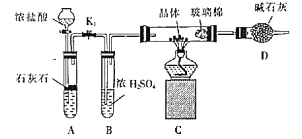
(3)利用如图装置对所得产品(FeSO4nH2O)结晶水的含量进行测定。反应前称量C中的硬质玻璃管(80g)、装入晶体后的硬质玻璃管(93g)。反应后称得C中硬质玻璃管的质量为87.6g。则产品硫酸亚铁晶体(FeSO4nH2O)中n=__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com