
【题目】铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法正确的是
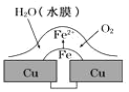
A.阳极电极反应式为:2H++2e→H2↑
B.此过程中电子从 Fe 移向 Cu,铁铆钉发生还原反应
C.此过程中铜会被腐蚀,发生氧化反应
D.此过程中铁做负极,被氧化
【答案】D
【解析】
水中溶解了氧气,铜、铁和水构成了原电池,较活泼的金属作负极,较不活泼的金属作正极,发生吸氧腐蚀,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,原电池放电时,电子从负极流向正极。
A.正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故A错误;
B.此过程中电子从 Fe 移向 Cu,负极上发生的电极反应式为:Fe-2e-=Fe2+,铁铆钉发生氧化反应,故B错误;
C.该原电池中铜作正极,原电池放电时,负极失电子容易被腐蚀,正极被保护,所以铜不被腐蚀,故C错误;
D.此过程中铁做负极,电极反应式为:Fe-2e-=Fe2+,铁铆钉发生氧化反应,故D正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究小组经资料检索后发现,药物贝诺酯能可由乙酸水杨酸和对乙酰氨基酚在一定条件下反应制得,其反应的化学方程式为
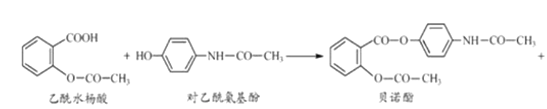 H2O
H2O
下列有关叙述错误的是( )
A.贝诺酯、乙酰水杨酸分子中都有酯基
B.对乙酰氨基酚的分子式为C8H9O2N
C.乙酰水杨酸能与NaHCO3溶液反应,并放出二氧化碳气体
D.贝诺酯与足量 NaOH 溶液共热,最终产物之一是乙酰水杨酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
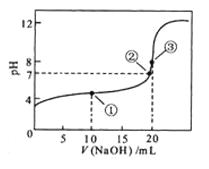
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(C3H3N)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产。以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下。
①C3H6(g)+NH3(g)+![]() O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1
O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1
②C3H6(g)+O2(g)C3H4O(g)+H2O(g) ΔH=353 kJ·mol1
请回答下列各题:
(1)关于上述反应,下列说法正确的是____。
A.增大压强有利于提高丙烯腈平衡产率
B.反应②的ΔS等于零
C.可以选择合适的催化剂来提高混合气中丙烯腈的生产效率
D.上述反应在恒温、恒容密闭容器中进行,若H2O(g)浓度保持不变,则说明两反应均达到平衡状态
(2)一定温度下,在体积不变的容器中充入C3H6、NH3、O2各1mol,一定时间后反应达到平衡状态,测得容器内C3H6和H2O的物质的量分别为0.4mol和1.4mol,该温度下反应②的平衡常数为____。
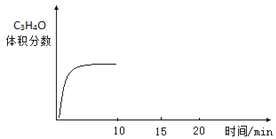
(3)若向容器内充入3mol C3H6和1mol O2只发生反应②,一定时间达到平衡状态,10min时再充入1mol O2,15min重新达到平衡,请在图中画出10min~20min内C3H4O的百分含量的变化图__________。
(4)如图为一定时间内丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃。下列说法正确的是_____。

A.460℃之前产率随温度升高而增大是因为随温度升高反应平衡常数变大
B.高于460℃产率下降的原因可能是温度升高催化剂活性降低
C.460℃时C3H6的转化率一定大于500℃
D.温度过高副反应可能变多不利于合成丙烯腈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,也是重要的化工原料。某化学兴趣小组在实验室制备氨并完成相关性质实验。
I.实验室制取氨气通常有两种方法:①固体氢氧化钙与氯化铵共热制备氨气(装置如图 甲②在锥形瓶中加入NaOH固体,在分液漏斗中加入浓氨水制备氨气(装置如图乙)。请回答:
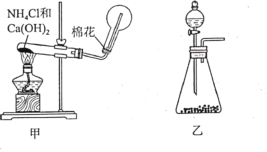
(1)用方法①制备并收集NH3 。装置甲中生成NH3的化学方程式为______。用圆底烧瓶收集NH3的方法为_____(填“向上排空气法”或“向下排空气法”),检验圆底烧瓶中已收集满氨气的方法是_______。
(2)利用装置乙可用方法②制取氨气,利用该装置还可制取_____(填字母)等气体。
a.H2 b.CO2 c.Cl2
II.该化学兴趣小组设计了如图所示的实验装置模拟工业生产制备少量硝酸。
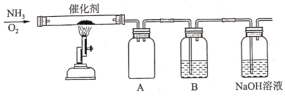
(1)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后移走酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是______反应(填“吸热”或“放热”)。
(2)B中试剂为 __________,NaOH溶液的作用是________。
(3)控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟,白烟的化学式是_________。欲使氨气尽可能完全转化为_______,理论上n(NH3) : n(O2)的最佳比例为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学常见的物质,它们之间有如下转化关系(反应条件及副产物已略去)。
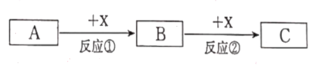
(1)若A和X均为单质,B为可使品红溶液褪色的气体,则反应②的化学方程式为____。
(2)若A、B、C为含钠元素的化合物,X为无色无味气体,则反应②的化学方程式为______ 。
(3)若A为稀硝酸,B溶液和硫氰酸钾溶液反应后溶液显红色,则反应②的离子方程式为_____。若向C的溶液中加入氢氧化钠溶液产生白色沉淀,在空气中迅速变成_____,最后变成_______,白色沉淀发生上述变化的原因 ______(用化学方程式表示)。56 g X与足量的稀硝酸发生反应,被还原的HNO3为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解技术,以氯化氢为原料回收氯气的过程如图所示,下列说法不正确的是
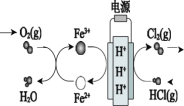
A.H+由阳极区向阴极区迁移
B.阴极电极反应:Fe3+ + e- =Fe2+
C.阴极区发生的反应有:4Fe2+ + O2 + 4H+ =4Fe3+ + 2H2O
D.阳极电极反应:2HCl + 2e- = Cl2 + 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如下实验探究铁钉在不同溶液中的吸氧腐蚀。
实验装置 | 实验编 号 | 浸泡液 | pH | 氧气浓度随时间的变化 |
| ① | H2O | 7 |
|
② | 1.0 mol·L-1 NH4Cl | 5 | ||
③ | 0.5 mol·L-1 (NH4)2SO4 | 5 | ||
④ | 1.0 mol·L-1 NaCl | 7 | ||
⑤ | 0.5 mol·L-1Na2SO4 | 7 |
下列说法不正确的是
A.①与④⑤比较说明盐溶液可以加快吸氧腐蚀速率
B.向实验②溶液中加等体积的 0.5 mol·L-1 (NH4)2SO4,吸氧腐蚀速率一定加快
C.②与③、④与⑤比较说明吸氧腐蚀速率可能与阴离子种类有关
D.向实验⑤溶液中加入少量(NH4)2SO4 固体,吸氧腐蚀速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com