
【题目】钡盐生产过程中排出大量钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],某工厂本着资源利用和降低生产成本的目的。在生产BaCO3同时,充分利用钡泥来制取Ba(NO3)2晶体及其它副产品,其部分工艺流程如下:

已知: ①Fe(OH)3和Fe(OH)2完全沉淀时溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中的溶解度大,在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤。用离子方程式说明该提纯的原理 。
(2)上述流程中Ba(FeO2)2与HNO3溶液反应生成两种盐,反应的化学方程式为 。
(3)结合本厂生产实际,X试剂应选下列中的 。
A.BaCl2 B.BaCO3 C.Ba(NO3)2 D.Ba(OH)2
(4)废渣2为 。
(5)操作III为 。
(6)过滤III后的母液应循环到容器 中(选填a、b、c) 。
(7)称取w克的晶体样品溶于蒸馏水中加入足量的稀硫酸,反应后经一系列操作称重所得沉淀质量为m克,则该晶体的纯度可表示为______________。
【答案】(1)BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)
BaCO3(s)+SO42-(aq)
【不写(s)、(aq)不扣分,写等号不扣分】
(2)Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O 【未配平不给分】
(3)B(4)Fe(OH)3 (5)蒸发浓缩、冷却结晶 【浓缩、结晶即给分】
(6)C(7)261m/(233w)×100% 【不乘以100%也给分】
【解析】
试题分析:
(1)根据题目已知信息可知Ksp(BaCO3)>Ksp(BaSO4),BaSO4尽管难溶,也存在一定的溶解度,只要加入足量的饱和Na2CO3溶液,使c(Ba2+)·c(CO32-)>Ksp(BaCO3),就可以发生沉淀的转化,而形成BaCO3沉淀,使BaSO4不断溶解,最后转化为BaCO3,用离子方程式表示为BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq);
BaCO3(s)+SO42-(aq);
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐硝酸钡、硝酸铁,同时产生水,根据质量守恒定律可得该反应的化学方程式为:Ba(FeO2)2+8HNO3 = Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)A、BaCl2可以与硫酸根离子发生沉淀反应,但是不能与H+发生反应,因此不能调节溶液的pH,而且会引入杂质离子Cl-,A错误;B、BaCO3能与H+发生反应,因此能调节溶液的pH,也不引入新的杂质离子,符合题意,B正确;C、Ba(NO3)2不能与H+发生反应,因此不能调节溶液的pH,C错误;D、Ba(OH)2能与H+发生反应,能调节溶液的pH,但是该物质是强碱,制取物质成本高,造价高,不经济,D错误,答案选B;
(4)pH大于3.2时就完全沉淀,所以废渣2为Fe(OH)3。
(5)由于Ba(NO3)2在热水中的溶解度大, 在冷水中的溶解度小,所以操作III为蒸发浓缩、冷却结晶。
(6)过滤3后的母液是析出Ba(NO3)2晶体后的Ba(NO3)2的饱和溶液,为使物质循环利用,根据各个容器中物质的成分可知应循环到容器C中;
(7)Ba(NO3)2晶体溶于水与加入的硫酸溶液发生反应:Ba2++SO42-=BaSO4↓,n(BaSO4)= m g÷233g/mol=m/233mol;由于Ba(NO3)2的式量是261,因此w g晶体中含有Ba(NO3)2的质量是m[Ba(NO3)2]= m/233mol×261g/mol=261m/233g,所以该晶体中硝酸钡的质量分数是[261m/233g] ÷w×100%=261m/233w×100%。


科目:高中化学 来源: 题型:
【题目】【选修3:物质结构与性质】
在电解冶练铝的过程中加入冰晶石,可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3═2Na3AlF6+3CO2↑+9H2O.根据题意完成下列填空:
(1)冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在__________(填序号).
a.离子键 b.极性键 c.配位键 d.范德华力
(2)CO2分子的空间构型为__________,中心原子的杂化方式为__________,和CO2 互为等电子体的氧化物是__________;
(3)反应物中电负性最大的元素为_________(填元素符号),写出其原子最外层的电子排布图__________;
(4)冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是______(填具体的微粒符号).
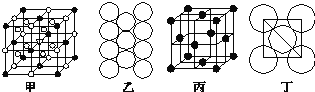
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:
若已知Al的原子半径为d cm,NA代表阿伏伽德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为_________个;Al晶体的密度为__________(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应速率有重要的意义。对于2A(g)+B(g)![]() 3C(g)+4D(g),
3C(g)+4D(g),
下列反应速率最快的是( )
A.vB= 0.3 mol·L-1·min-1 B.vA= 0.5 mol·L-1·min-1
C.vC= 0.8 mol·L-1·min-1 D.vD= 1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向某密闭容器中加入1molN2和4molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入的物质的量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:
(1)恒定T、V:
[1]若X=0,Y=1,则Z= 。
[2]若X=0.75,Y= ,Z=0.5。
[3]X、Y、Z应满足的一般条件是(分别用只含X、Z和只含Y、Z写两个方程式表示) 。
(2)恒定T、P:
[1]若X=1、Y= ,则Z=2。
[2]若X=2,则Y=10,Z= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知金刚石在一定条件下转化成石墨是放热的。据此,以下判断或说法正确的是( )。
A.需要加热方能发生的反应一定是吸热反应
B.放热反应在常温下一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 H <0(Ⅰ)
NaNO3(s)+ClNO(g) K1 H <0(Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 H <0 (Ⅱ)
2ClNO(g) K2 H <0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向 2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡。测得10min内v(ClNO)=7.5×10-3molL-1min-1,则:平衡后n(Cl2)= mol,NO的转化率а1= ,其它条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”)。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得 1L溶液A,溶液B为0.1molL1的CH3COONa溶液,则两溶液中c(NO3)、c(NO2-)和c(CH3COO)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4molL1,CH3COOH的电离常数Ka=1.7×10-5molL1)。
可使溶液A和溶液B的pH相等的方法是 。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷在常温下是无色液体,密度是2.18g/cm3,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂.在实验室可用如图所示装置来制备1,2-二溴乙烷.其中试管c中装有浓溴水.

(1)写出制备1,2-二溴乙烷的化学方程式:_____________________。
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c是否发生堵塞。如果发生堵塞,a中的现象是:______.
(3)容器b中NaOH溶液的作用是______,相应的离子方程式为________________,可能发生反应的离子方程式为__________________________。
(4)将试管c置于冷水中,以及液溴表面覆盖少量水的原因是:____________。
(5)某同学在做实验时,使用一定量的液溴,当溴全部褪色时,通入的乙烯混合气体的量比正常情况下超出许多。如果装置的气密性没有问题,试分析可能的原因:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是 ________。用O2表示从0~2 s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是_______(填序号)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,制得的乙烯中混有CO2、SO2等杂质。某课外小组设计了如下装置,证明乙烯中混有CO2、SO2并验证乙烯的性质。
回答下列问题:

(1)装置A是乙烯的发生装置。图中一处明显的错误是__________,烧瓶中碎瓷片的作用是__________。
(2)若要检验A中所得气体含有SO2,可将混合合气体直接通入__________(填代号,下同)装置;若要检验,A中所得气体含有CH2=CH2,可将混合气体先通入B装置,然后通入__________装置。
(3)写出实验室制取乙烯的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com