
【题目】氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
(1)写出用KMn04滴定H2C2O4的离子方程式_____________________。
(2)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(3)判断滴定终点的方法是________________________。
(4)误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果________。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果________。
(5)计算:血液中含钙离子的浓度为________mol/L。
【答案】 2MnO4﹣+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O 酸式 当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色 偏高 偏高 2.5×10﹣3
【解析】(1)高锰酸钾具有强氧化性,在硫酸条件下将H2C2O4氧化为CO2,自身被还原为MnSO4,反应方程式为2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2MnO4-+5H2C2O4+6H+= 2Mn2++10CO2↑+8H2O;
(2)高锰酸钾具有氧化性,能够腐蚀乳胶管,应该用酸式滴定管盛放,故答案为:酸式;
(3)高锰酸钾溶液本身有颜色,为紫色,在开始滴入草酸中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液由无色变为浅紫色,且半分钟内不褪色,故答案为:当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色;
(4)①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,导致滴定后消耗的高锰酸钾溶液的体积偏大,则测量结果偏高,故答案为:偏高;
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,导致滴定后消耗的高锰酸钾溶液的体积偏大,则测量结果偏高,故答案为:偏高;
(5)由CaC2O4+H2SO4═CaSO4+H2C2O4、2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可以得出关系式:5Ca2+~2KMnO4,所以n(Ca2+)=2.5n(KMnO4)=1.0×10-4mol/L×0.02L×2.5=5×10-6mol,血液中含钙离子的浓度为![]() =2.5×10﹣3mol/L,故答案为:2.5×10﹣3。
=2.5×10﹣3mol/L,故答案为:2.5×10﹣3。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下列关于硅及二氧化硅的说法中正确的是( )
A. 高纯度的硅可用于制造计算机芯片 B. SiO2的物理性质与CO2类似
C. 熔融烧碱样品使用的器皿是石英坩埚 D. 光导纤维的主要成分是Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是
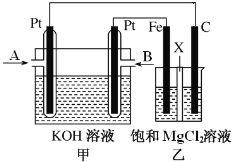
A.甲中A处通入CH4,电极反应式为CH4+10OH8e![]() +7H2O
+7H2O
B.乙中电解MgCl2溶液的总反应为2Cl+2H2O![]() Cl2↑+H2↑+2OH
Cl2↑+H2↑+2OH
C.理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
D.甲、乙中电解质溶液的pH都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2 L的密闭容器中充入2 mol SO2和1 mol O2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
A. 充入2 mol SO3后,SO2的物质的量增大
B. 第一次反应达到平衡时共放出热量176.4 kJ
C. 充入2 mol SO3达到新平衡时,容器内的压强为1.4p
D. 降低容器的温度可使新平衡时各物质的体积分数与第一次平衡时相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一反应:2A+B![]() 2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )
2C,其中A、B、C均为气体,下图中的曲线是该反应在不同温度下的平衡曲线,x轴表示温度,y轴表示B的转化率,图中有a、b、c三点,如图所示,则下列描述正确的是( )

A. 该反应是放热反应
B. b点时混合气体的平均摩尔质量不再变化
C. T1温度下若由a点达到平衡,可以采取增大压强的方法
D. 在达到平衡的过程中,c点v(正)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g) + 5O2 (g) ![]() 4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1K= 1.1×1026
4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1K= 1.1×1026
② 4NH3 (g) + 4O2 (g) ![]() 2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1K= 4.4×1028
2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1K= 4.4×1028
③ 4NH3 (g) + 3O2 (g) ![]() 2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1K= 7.1×1034
2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1K= 7.1×1034
其中,②、③是副反应。若要减少副反应,提高NO的产率,最合理的措施是
A.减小压强 B.降低温度
C.增大O2浓度 D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)=2AB2(g) (A2、B2、AB2的结构式分别为A=A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是
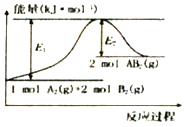
A. 该反应若生成2molAB2(g)则吸收的热量为(El-E2)kJ
B. 该反应的进行一定需要加热或点燃条件
C. 该反应断开化学键消耗的总能量小于形成化学键释放的总能量
D. 生成2molB-B键放出E2kJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com