
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为______________________。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是_________________。
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)
【答案】2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=-46 kJ·mol-1CH4O2+2H2O+4e-=4OH-变小不变CO32-1.12
【解析】
(1)①CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJmol-1,②2CO(g)+O2(g)═2CO2(g)△H=-566kJmol-1,将方程式2①+②得 2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJmol-1 ,故答案为:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJmol-1 ;
(2)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以a处通入的气体是甲烷;甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为CH4+10OH--8e-=CO32-+7H2O,b处通入氧气,电极反应式为O2+2H2O+4e-=4OH-,故答案为:CH4;O2+2H2O+4e-=4OH-;
②根据I中电池反应为CH4+2O2+2KOH=K2CO3+3H2O,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量,则溶液中铜离子浓度不变,故答案为:变小;不变;
③I中负极反应为CH4+10OH--8e-=CO32-+7H2O,所以还有碳酸根离子生成,故答案为:CO32-;
④串联电路中转移电子相等,所以消耗甲烷的体积=![]() ×22.4L/mol=1.12L,故答案为:1.12。
×22.4L/mol=1.12L,故答案为:1.12。


科目:高中化学 来源: 题型:
【题目】我国三峡工程所提供的清洁、廉价、可再生的水电,相当于每年燃烧3000万吨原煤的火力发电厂产生的电能,因此三峡工程有助于控制
①温室效应 ②S02的排放 ③白色污染 ④臭氧空洞
A. ①②③④ B. ①②③ C. ①②④ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
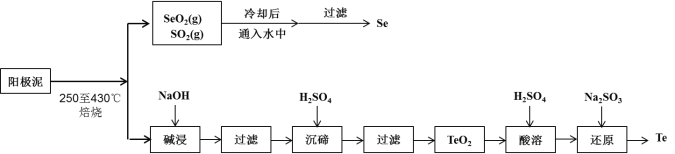
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:从石油中获得A是目前工业上生产A的主要途径,A的产量通常用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
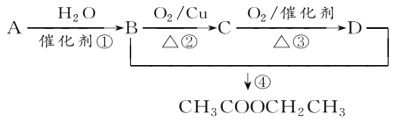
回答下列问题:
(1)写出A的结构简式______________。
(2)B、D分子中的官能团名称分别是__________________、________________。
(3)写出下列反应的反应类型:①________,②________,④________。
(4)写出下列反应的化学方程式:
①_______________________________;
④_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同质量的铝分别投入足量的下列物质中反应生成氢气,消耗溶质物质的量最少的是
A. 稀硫酸 B. 稀盐酸 C. 氢氧化钡溶液 D. 氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池式氧传感器原理构造如图,可测定O2的含量。工作时铅极表面会逐渐附着Pb(OH)2。下列说法不正确的是( )
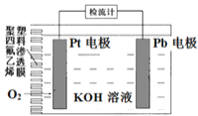
A. Pt电极上发生还原反应
B. 随着使用,电解液的碱性逐渐减弱
C. a ×10-3molO2反应,理论上可使Pb电极增重68a mg
D. Pb电极上的反应式为Pb+2OH--2e-=Pb(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的项重大贡献。
(1)某课外实验小组欲探究铝和铜的金属性(原子失电子能力)强弱,同学们提出了如下实验方案:
A.比较铝和铜的硬度和熔点
B.比较二者在稀硫酸中的表现
C.用铝片、铜片、硫酸铝溶液、硫酸铜溶液,比较二者的活动性
D.分别做铝片、铜片与NaOH溶液反应的实验
E.将铝片、铜片用导线连接后共同投入稀盐酸中接入电流计,观察电流方向
上述方案中能达到实验目的的是_________________。
(2)现有如下两个反应:A.NaOH+HCl=NaCl+H2O B.Zn+H2SO4=ZnSO4+H2↑。上述反应中能设计成原电池的是________ (填字母代号),作负极的物质发生了________反应(填“氧化”或“还原”)。
(3)将纯锌片和纯铜片按如图所示方式插入100mL相同浓度的稀硫酸一段时间,回答下列问题:

①下列说法正确的是________ (填字母代号)。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的酸性均减弱
②在相同时间内,两烧杯中产生气泡的速度:甲________乙(填“>”、“<”或“=”)。原因是________。
③当甲中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1L,测得溶液中c(H+)=0.1mol/L(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com