
A、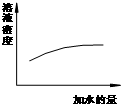 浓硫酸的稀释 |
B、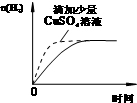 等量的盐酸与过量的锌粉反应 |
C、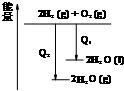 氢气与氧气反应中的能量变化 |
D、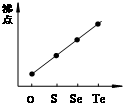 气态氢化物沸点 |


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
| A、是一种共价化合物 |
| B、可由PH3与HI化合生成 |
| C、在加热的条件下,可以分解产生有色气体 |
| D、能跟碱反应放出PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol NaHSO4晶体中离子总数为2NA |
| B、4.4 g 14CO2含中子数为2.4NA |
| C、0.1 L 3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| D、1 mol Fe在氧气中充分燃烧失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
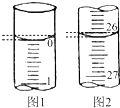 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
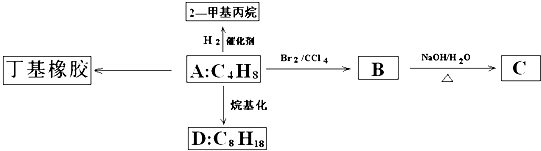
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-+H2O?HCO3-+OH- Na2CO3与Al2(SO4)3溶液混合作灭火剂 |
| B、Al3++3H2O?Al(OH)3+3H+ 明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?xH2O↓+4HCl 制备TiO2纳米粉 |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
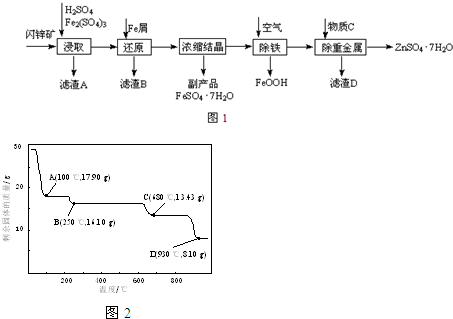
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.02 | B、0.04 |
| C、0.08 | D、0.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com