
| A、CO32-+H2O?HCO3-+OH- Na2CO3与Al2(SO4)3溶液混合作灭火剂 |
| B、Al3++3H2O?Al(OH)3+3H+ 明矾净水 |
| C、TiCl4+(x+2)H2O(过量)?TiO2?xH2O↓+4HCl 制备TiO2纳米粉 |
| D、SnCl2+H2O?Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入浓盐酸 |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
| A、2Fe2++I2=2Fe3++2I- |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+I2+2H2O=H2SO4+2HI |
| D、H2O2+SO2=H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
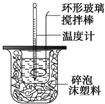 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 有关问题 |
| (1)计算所需KCl的质量 | 需要KCl的质量为 |
| (2)称量KCl固体 | 称量过程中主要用到的仪器是 |
| (3)将KCl加入100mL烧杯中,加适量蒸馏水溶解 | 为加快溶解,可采取的措施是 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应该采取的措施是 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 实验方案 |
| A | 验证Ksp(AgCl)>Ksp(AgI) | 向NaCl溶液中滴加AgNO3溶液,产生白色沉淀,再滴加KI溶液,可观察到白色沉淀转化为黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置.可观察到下层液体呈紫色 |
| D | 比较确定铜和镁的金属活动性强弱 | 用石墨作电极电解Mg(NO3)2、Cu(NO3)2的混合液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com