
【题目】将一定量的C12通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和C1O3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )
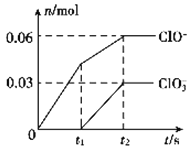
A.反应中转移电子的物质的量是0.21mol
B.C1O3-的生成可能是由于温度升高引起的
C.苛性钾溶液中KOH的质量是16.8g
D.一定有3.36L氯气参加反应
【答案】D
【解析】
试题分析:A.氯气和氢氧化钠溶液反应生成次氯酸钠、氯化钠和氯酸钠,根据图象知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,故转移电子物质的量=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故A正确;B.根据图象知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故B正确;C.根据电子转移守恒可知n(Cl-)=0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,则n(KOH)=0.3mol,则氢氧化钾质量=0.3mol×56g/mol=16.8g,故C正确;D.根据氯原子守恒可知参加反应的氯气为0.15mol,氯气的状态未知,不能确定其体积,故D错误;故选D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO45H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2:CuSO45H2O受热分解的化学方程式为CuSO45H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为△H3,则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H3,则下列判断正确的是( )
A.△H2>△H3 B.△H1<△H3
C.△H1+△H3=△H2 D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-802kJ·mol-1
则CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH= kJ·mol-1。
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2在一定条件下发生反应 CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图
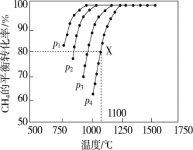
据图可知,p1、p2、p3、p4由大到小的顺序是 。在压强为p4、1100 ℃的条件下,该反应在5 min时达到平衡点X,该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)![]() CO(g)+H2(g)来制取。
CO(g)+H2(g)来制取。
①在恒温恒容下,如果从反应物出发建立平衡,可认定反应已达到平衡的是__________。
A.体系压强不再变化 B.H2与CO的物质的量之比为1∶1
C.混合气体的密度保持不变 D.气体平均相对分子质量为15,且保持不变
②在某密闭容器中同时投入四种物质,2 min时达到平衡,测得容器中有1 mol H2O(g)、1 mol CO(g)、2.2 molH2(g)和一定量的C(s),若此时对体系加压,则平衡向 (填“正”或“逆”)反应方向移动,第5 min时达到新的平衡,请在右图中画出2~5 min容器中气体平均相对分子质量的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如下图所示。则原H2SO4物质的量浓度是( )

A.1mol/L B.2mol/L C.3mol/L D.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是( )
A.除去CO2中混有的SO2:用氢氧化钠溶液洗气
B.除去Cl2中混有的HCl:用饱和食盐水洗气
C.除去FeCl2溶液中混有的FeCl3:加入过量铜粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见物质。其中,B、E为金属单质,D为气体。反应①②是置换反应,反应①②③均在高温下进行。A为常温下最常见的液体,C有磁性,E、F既能溶于NaOH又能溶于HCl。
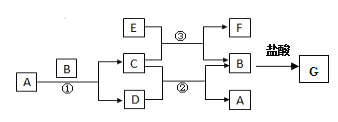
(1)C的化学式 ,C与足量盐酸反应的离子方程式 ;
(2)反应③化学方程式 ;E加入过量的NaOH溶液对应离子反应方程式 ;
(3)G溶液中加入酸性的H2O2溶液后变黄色,对应离子反应方程式 ;
(4)纯净G的溶液中金属阳离子检验方法 ;向G溶液中加入NaOH溶液后的现象是 ;反应的化学方程式为 ;
(5)F与氢氧化钠反应的化学方程式为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷和红磷都是磷元素的单质,已知31g红磷完全转化成白磷时,要吸收E kJ的能量,下列说法正确的是( )
A.白磷不如红磷稳定
B.等质量时,红磷能量高于白磷
C.红磷转化成白磷不属于化学变化
D.等质量的红磷与白磷完全燃烧,白磷放出的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾)。可用下列装置制备。


(1)装置B中盛放 溶液,其作用是 。F中的是 溶液,其作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
(2)装置A实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(3)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出很多实验方案,其中方案之一为让残留的液体与足量Zn反应,测量生成的H2体积。装置如右图所示(夹持器具已略去)。
①使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
②反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。
(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol NaHCO3和一定量的Na2O2固体混合,在加热的条件下使其反应,经测定无Na2O2剩余,则最后所得固体的物质的量(n)为
A.1 mol<n≤2 mol B.2 mol<n≤4 mol C.1 mol<n≤4 mol D.n>4 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com