
【题目】研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-802kJ·mol-1
则CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH= kJ·mol-1。
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2在一定条件下发生反应 CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图
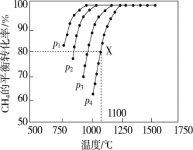
据图可知,p1、p2、p3、p4由大到小的顺序是 。在压强为p4、1100 ℃的条件下,该反应在5 min时达到平衡点X,该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)![]() CO(g)+H2(g)来制取。
CO(g)+H2(g)来制取。
①在恒温恒容下,如果从反应物出发建立平衡,可认定反应已达到平衡的是__________。
A.体系压强不再变化 B.H2与CO的物质的量之比为1∶1
C.混合气体的密度保持不变 D.气体平均相对分子质量为15,且保持不变
②在某密闭容器中同时投入四种物质,2 min时达到平衡,测得容器中有1 mol H2O(g)、1 mol CO(g)、2.2 molH2(g)和一定量的C(s),若此时对体系加压,则平衡向 (填“正”或“逆”)反应方向移动,第5 min时达到新的平衡,请在右图中画出2~5 min容器中气体平均相对分子质量的变化曲线。
【答案】
(1)+248;
(2)P4>P3>P2>P1;1.64;
(3)①AC;
②逆; 。
。
【解析】
试题分析:(1)已知反应①2CO(g)+O2(g)═2CO2(g)△H=-566kJmol-1,
②2H2(g)+O2(g)═2H2O(g)△H=-484kJmol-1,
③CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H=-802kJmol-1,
根据盖斯定律,将③-①-②可得:CH4(g)+CO2(g)2CO(g)+2H2(g)
△H=(-802kJmol-1)-(-566kJmol-1) -(-484kJmol-1)=+248KJ/mol,故答案为:+248;
(2)由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1;由图1可知,压强为P4、1100℃的条件下,该反应5min时达到平衡X点,是甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,
CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g),
2CO(g)+2H2(g),
开始(mol/L):0.1 0.1 0 0
变化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故该温度下平衡常数k=![]() =1.64,故答案为:P4>P3>P2>P1;1.64;
=1.64,故答案为:P4>P3>P2>P1;1.64;
(3)①A、正反应方向是个气体体积增大的方向,故随着反应的进行,平衡之前,体系压强会增大,故一旦当体系压强不变,说明反应达平衡,故A正确;B、CO与H2的化学计量数为1:1,反应数值按物质的量比为1:1进行,不能说明到达平衡,故B错误;C、混合气体的密度ρ=![]() ,容器恒容,即V不变,随着反应的进行,混合气体的质量m增大,故ρ增大,一旦当ρ不变时,说明反应达平衡,故C正确;D、反应混合物的总质量不变,随反应进行,反应混合物的总的物质的量增大,平均相对分子质量减小,混合气体的平均相对分子质量不发生变化,说明到达平衡,但达平衡时,平均相对分子质量不一定是15,故D错误;故选AC;
,容器恒容,即V不变,随着反应的进行,混合气体的质量m增大,故ρ增大,一旦当ρ不变时,说明反应达平衡,故C正确;D、反应混合物的总质量不变,随反应进行,反应混合物的总的物质的量增大,平均相对分子质量减小,混合气体的平均相对分子质量不发生变化,说明到达平衡,但达平衡时,平均相对分子质量不一定是15,故D错误;故选AC;
②根据勒沙特列原理可知,增大压强,平衡向着气体体积减小的方向移动,此反应的逆反应方向是个气体体积减小的方向,故增大压强,向逆反应方向移动;在第2min时,混合气体的平均相对分子质量即平均摩尔质量![]() =
=![]() =
=![]() =12g/mol。设在第2~5min期间的任何时刻,有XmolH2被消耗,则有:
=12g/mol。设在第2~5min期间的任何时刻,有XmolH2被消耗,则有:
C(s)+H2O(g)CO(g)+H2(g/span>)
初始量(mol)1 1 2.2
转变量(mol)X X X
剩余量(mol)(1+X) (1-X) (2.2-X)
混合气体的平均相对分子质量即平均摩尔质量![]() =
=![]() =
=![]() =12,故可知在2~5min期间的任意时刻,混合气体的平均相对分子质量不变,一直是12,故可得2~5min内容器中气体平均相对分子质量的变化曲线为
=12,故可知在2~5min期间的任意时刻,混合气体的平均相对分子质量不变,一直是12,故可得2~5min内容器中气体平均相对分子质量的变化曲线为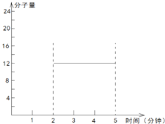 ,故答案为:逆;
,故答案为:逆;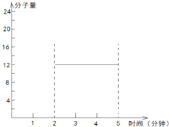 。
。


科目:高中化学 来源: 题型:
【题目】据《荆楚岁时记》记载,五月的第一个午日是登高顺阳好天气之日,故五月初五称为“端午节”,粽子是大家熟悉的端午节庆食物。制作粽子会用到的部分原料有:①糯米、②蔗糖、③红枣、④鲜肉。请回答:
(1)富含淀粉的是______(填序号,下同)。
(2)富含蛋白质的是______。
(3)富含维生素C的是______。
(4)属于调味剂的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月,中国科学家屠呦呦获得了诺贝尔生理学奖,获奖理由是“因为发现青蒿素—一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素的分子式为C15H22O5,则关于青蒿素的说法中正确的是
A.青蒿素是一种氧化物
B.青蒿素的摩尔质量为282
C.56.4g青蒿素中所含氧原子数目为6.02×1023个
D.青蒿素中C、H、O元素的质量比为15:22:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.利用含锰废水(主要含Mn2+、SO42-、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:
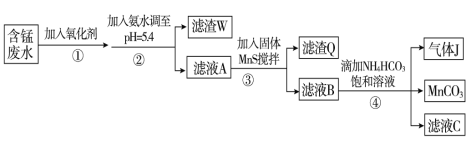
已知某些物质完全沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
沉淀完全时的pH | 3.2 | 5.4 | 6.4 | 9.8[ | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)过程②中,所得滤渣W的主要成分是 。
(2)过程③中,发生反应的离子方程式是 。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程
式是 。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2=2MnO2+2CO2。现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是 (用百分数表示,小数点后保留1位小数)。
Ⅱ.常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是 。
(2)根据表中数据判断,浓度均为0.01 mol·L-1的下列物质的溶液中,酸性最强的是 (填序号)。
A.HCN
B.HClO
C.C6H5OH
D.CH3COOH
E.H2CO3
(3)根据上表数据,请你判断下列反应不能成立的是 (填序号)。
A.HCN+Na2CO3=NaHCO3+NaCN
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
D.CH3COONa+HClO=NaClO+CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关。下列说法不正确的是
A. Al2O3作耐火材料是因为氧化铝熔点高
B. “血液透析”利用了胶体的性质
C. 糖类、油脂、蛋白质均能发生水解
D. 家用燃煤中适量的生石灰能有效减少二氧化硫的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Al片和Cu片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成了原电池,则在这两个原电池中,正极分别为( )
A. Al片、Cu片 B. Cu片、Al片
C. Cu片、Cu片 D. Al片、Al片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
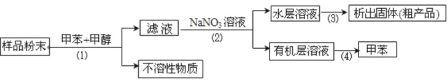
(1)从下图中选择与步骤(1)(2)(3)(4)分别对应的装置图________、________、________、________(填字母)
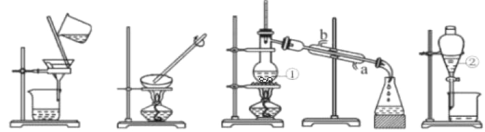
A B C D
(2)写出下列仪器的名称:①_________;②__________;①中沸石的作用为__________;
(3)冷凝水的进水方向:__________。(填“a”或“b”)
(4)下列能用装置D进行分离的是__________。
A.液溴和四氯化碳
B.乙醇和煤油
C.苯和蒸馏水
D.氯化钠和水
(5)装置A、B中玻璃棒的作用分别是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的C12通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和C1O3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )
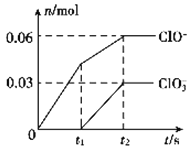
A.反应中转移电子的物质的量是0.21mol
B.C1O3-的生成可能是由于温度升高引起的
C.苛性钾溶液中KOH的质量是16.8g
D.一定有3.36L氯气参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关病毒遗传物质的叙述中,正确的是
A. 都是脱氧核糖核酸
B. 都是核糖核酸
C. 脱氧核糖核酸和核糖核酸
D. 有的是脱氧核糖核酸,有的是核糖核酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com