
【题目】将Al片和Cu片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成了原电池,则在这两个原电池中,正极分别为( )
A. Al片、Cu片 B. Cu片、Al片
C. Cu片、Cu片 D. Al片、Al片
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法正确的是( )
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法正确的是( )
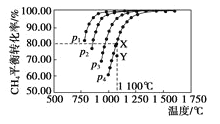
A.上述反应的△H>0 B.压强P1>P2>P3>P4
C.1100℃该反应的平衡常数为64 D.压强为P4时,在Y点:v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.物质发生化学变化都伴随着能量变化
B.任何反应中的能量变化都表现为热量变化
C.伴有能量变化的物质变化都是化学变化
D.化合反应都是放热的,分解反应都是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质应用的说法正确的是( )
A.碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油和污渍
B.钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂
C.常温下,浓硝酸不跟铁发生化学反应,可用铁制容器盛装浓硝酸
D.铝表面易形成致密的氧化膜,铝制器皿可长时间盛放咸菜等腌制食品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-802kJ·mol-1
则CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH= kJ·mol-1。
(2)在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2在一定条件下发生反应 CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图
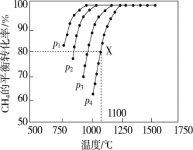
据图可知,p1、p2、p3、p4由大到小的顺序是 。在压强为p4、1100 ℃的条件下,该反应在5 min时达到平衡点X,该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)![]() CO(g)+H2(g)来制取。
CO(g)+H2(g)来制取。
①在恒温恒容下,如果从反应物出发建立平衡,可认定反应已达到平衡的是__________。
A.体系压强不再变化 B.H2与CO的物质的量之比为1∶1
C.混合气体的密度保持不变 D.气体平均相对分子质量为15,且保持不变
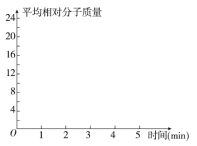
②在某密闭容器中同时投入四种物质,2 min时达到平衡,测得容器中有1 mol H2O(g)、1 mol CO(g)、2.2 molH2(g)和一定量的C(s),若此时对体系加压,则平衡向 (填“正”或“逆”)反应方向移动,第5 min时达到新的平衡,请在右图中画出2~5 min容器中气体平均相对分子质量的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O![]() 2HBr+H2SO4,下列说法正确的是( )
2HBr+H2SO4,下列说法正确的是( )
A.Br2在反应中表现还原性 B.SO2在反应中被还原
C.Br2在反应中失去电子 D.1mol Br2在反应中得到2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如下图所示。则原H2SO4物质的量浓度是( )

A.1mol/L B.2mol/L C.3mol/L D.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见物质。其中,B、E为金属单质,D为气体。反应①②是置换反应,反应①②③均在高温下进行。A为常温下最常见的液体,C有磁性,E、F既能溶于NaOH又能溶于HCl。
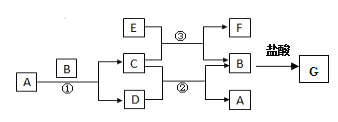
(1)C的化学式 ,C与足量盐酸反应的离子方程式 ;
(2)反应③化学方程式 ;E加入过量的NaOH溶液对应离子反应方程式 ;
(3)G溶液中加入酸性的H2O2溶液后变黄色,对应离子反应方程式 ;
(4)纯净G的溶液中金属阳离子检验方法 ;向G溶液中加入NaOH溶液后的现象是 ;反应的化学方程式为 ;
(5)F与氢氧化钠反应的化学方程式为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途。
(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定,
①画出基态Cu原子的价电子轨道排布图_______________;
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因_________________;
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4·H2O晶体。
①沉淀溶解的离子方程式为_________________________;
②Cu(NH3)4SO4·H2O晶体中存在的化学键有__________;
a.离子键 b.极性键 c.非极性键 d.配位键
③SO42-的立体构型是__________,其中S原子的杂化轨道类型是_____________;

(3)Cu晶体中原子的堆积方式如图所示(为面心立方最密堆积),则晶胞中Cu原子的配位数为__________,若Cu晶体的晶胞参数a=361.4pm,则Cu晶体的密度是________(只用数字列算式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com