
| 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 | |
| A | Fe2+,N ,K+ ,K+ | 稀硫酸 | 3Fe2++N +4H+=3Fe3++NO↑+2H2O +4H+=3Fe3++NO↑+2H2O |
| B | Fe3+,I-,ClO- | 氢氧化钠溶液 | 3Fe3++3OH-=Fe(OH)3↓ |
| C | Ba2+,HC ,Cl- ,Cl- | 氢氧化钠溶液 | HC +OH-=C +OH-=C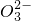 +H2O +H2O |
| D | Ag+,F-,N | 过量浓氨水 | Ag++OH-=AgOH↓ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
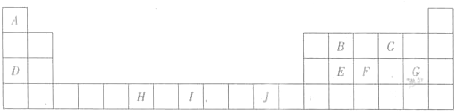
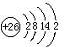
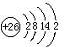
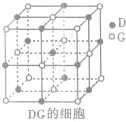 (3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的
(3)H3+离子在一定条件下能形成结构复杂的配离子[HG(A2C)5]2+形成该配离子时,H3+离子接受了配体提供的| 234 |
| a3NA |
| 234 |
| a3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnO4- | B、Cr2O72- | C、CIO3- | D、MnO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com