
已知浓H2SO4和Fe3+都可以将Cu氧化(Fe3+与Cu的反应为:2Fe3+ + Cu = 2Fe2+ + Cu2+),浓H2SO4还可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3,则有关物质氧化性强弱的顺序为
| A.H2SO4(浓) > Cu2+ > Fe3+ > Br2 | B.H2SO4(浓) > Br2 > Fe3+ > Cu2+ |
| C.Br2 > H2SO4(浓) > Cu2+ > Fe3+ | D.Cu2+ > Fe3+ > Br2 > H2SO4(浓) |
科目:高中化学 来源: 题型:单选题
从海藻灰中可以提取碘的主要反应为:2 I-+Cl2="2" Cl-+I2,下列说法正确的是
| A.该反应属于置换反应 | B.I-具有氧化性 |
| C.1mol氯气转移了1mol电子 | D.Cl2是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在炼铜的过程中发生:Cu2S + 2Cu2O =" 6Cu" + SO2↑,则下列叙述正确的是
| A.该反应从电子转移角度看,与SO2 + 2H2S =" 3S" + 2H2O是同一反应类型 |
| B.该反应从电子转移角度看,每生成6 mol铜,转移电子12 mol |
| C.该反应中,氧元素氧化了硫元素 |
| D.该反应中,Cu2S既是还原剂又是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是:
4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-
工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备——2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
干法制备——2FeSO4 +6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是( )
| A.高铁酸钾与水反应时,水发生氧化反应 |
| B.干法中每生成1mol Na2FeO4共转移4mol电子 |
| C.湿法中每生成1mol Na2FeO4共转移3mol电子 |
| D.K2FeO4处理水时,不仅能杀菌,还能除去H2S、NH3等,并使悬浮杂质沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O的有关叙述中,正确的是
| A.KCl中含有35Cl |
| B.生成物Cl2的相对分子质量为73.3 |
| C.该反应转移的电子数为6e- |
| D.氧化剂和还原剂的物质的量之比为1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50mg,则
| A.被氧化的砒霜为1.98mg |
| B.分解产生的氢气为0.672ml |
| C.和砒霜反应的锌为3.90mg |
| D.转移的电子总数为6×10―5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
吸进人体内的氧有2%转化为加速人体衰老的氧化性极强的活性氧,若Na2SeO3能清除人体内活性氧,则Na2SeO3的作用是
| A.还原剂 | B.氧化剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且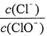 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
A.若某温度下,反应后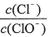 =11,则溶液中 =11,则溶液中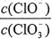 = =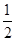 |
| B.参加反应的氯气的物质的量等于0.5amol |
C.改变温度,反应中转移电子的物质的量ne的范围: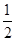 amol≤ne≤ amol≤ne≤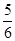 amol amol |
D.改变温度,产物中KC1O3的最大理论产量为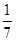 amol amol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
高温下焙烧CuFeS2的反应之一为2CuFeS2+7O2=CuSO4+CuO+Fe2O3+3SO2,下列关于该反应的叙述正确的是
| A.CuFeS2中硫的化合价为-1 |
| B.CuFeS2发生还原反应 |
| C.1 mol CuFeS2完全反应转移13 mol电子 |
| D.CuSO4和SO2既是氧化产物,又是还原产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com