
 如图所示是测定镁粉(含有少量杂质Al)纯度的实验装置,所用NaOH溶液的浓度为4.5mol/L,体积为100mL,不同时间段电子天平的读数如下表所示:
如图所示是测定镁粉(含有少量杂质Al)纯度的实验装置,所用NaOH溶液的浓度为4.5mol/L,体积为100mL,不同时间段电子天平的读数如下表所示:| 实验操作 | 时间(min) | 电子天平的读数(g) |
| 烧杯+NaOH溶液 | 120.0 | |
| 烧杯+NaOH溶液+样品 | 0 | 135.6 |
| 1 | 135.1 | |
| 2 | 134.7 | |
| 3 | 134.4 | |
| 4 | 134.4 |
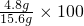 %=30.8%,
%=30.8%, =0.5mol/L,故答案为:反应后溶液中的c(OH-)为0.5mol/L.
=0.5mol/L,故答案为:反应后溶液中的c(OH-)为0.5mol/L.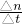 =
=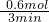 =0.2mol/min,
=0.2mol/min,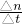 来分析.
来分析.

科目:高中化学 来源: 题型:
 常温下有下列四种溶液:
常温下有下列四种溶液:| ① | ② | ③ | ④ | |
| 溶液 | pH=4的NH4Cl | pH=4的盐酸 | 0.1mol?L-1的醋酸 | 0.1mol?L-1的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示是测定镁粉(含有少量杂质Al)纯度的实验装置,所用NaOH溶液的浓度为4.5mol/L,体积为100mL,不同时间段电子天平的读数如下表所示:
如图所示是测定镁粉(含有少量杂质Al)纯度的实验装置,所用NaOH溶液的浓度为4.5mol/L,体积为100mL,不同时间段电子天平的读数如下表所示:| 实验操作 | 时间(min) | 电子天平的读数(g) |
| 烧杯+NaOH溶液 | 120.0 | |
| 烧杯+NaOH溶液+样品 | 0 | 135.6 |
| 1 | 135.1 | |
| 2 | 134.7 | |
| 3 | 134.4 | |
| 4 | 134.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验操作 | 时间(min) | 电子天平的读数(g) |
| 烧杯+NaOH溶液 | 120.0 | |
| 烧杯+NaOH溶液+样品 | 0 | 135.6 |
| 1 | 135.1 | |
| 2 | 134.7 | |
| 3 | 134.4 | |
| 4 | 134.4 |

查看答案和解析>>
科目:高中化学 来源:2010-2011学年海南省海口市海南中学高一(上)期末化学试卷(解析版) 题型:解答题
| 实验操作 | 时间(min) | 电子天平的读数(g) |
| 烧杯+NaOH溶液 | 120.0 | |
| 烧杯+NaOH溶液+样品 | 135.6 | |
| 1 | 135.1 | |
| 2 | 134.7 | |
| 3 | 134.4 | |
| 4 | 134.4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com