
现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
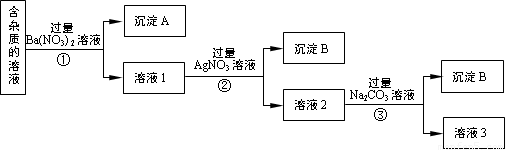
(1)沉淀A的主要成分是 、 (填化学式)。
(2)②中反应的离子方程式是 。
(3)①②③中均进行的分离操作是 。
(4)③中加入过量的Na2CO3溶液的目的是 。
(5)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是 ,为了除去杂质,可向溶液3中加入适量的 。
(6)实验室用上述实验获得的NaNO3固体配制500 mL 0.40 mol/L NaNO3溶液。
①配制溶液时,进行如下操作:a.定容;b.计算;c.溶解;d.摇匀;e.转移;f.洗涤;j.称量。称取NaNO3固体的质量是 g。按照操作顺序,第4步是 (填序号)。
②某同学转移溶液的操作如图所示,图中仪器的名称是烧杯和 ,该同学操作中的错误是 。
(1)BaSO4 BaCO3
(2)Ag++ Cl—== AgCl↓
(3)过滤
(4)除去Ba2+ 、Ag+
(5)Na2CO3 或CO32— 稀硝酸
(6)①17.0 e ②500mL容量瓶 未用玻璃棒引流
【解析】
试题分析:(1)向含有杂质的NaNO3溶液溶液中加入过量的Ba(NO3)2,发生反应:Na2SO4+ Ba(NO3)2= BaSO4↓+ 2NaNO3;Na2CO3+ Ba(NO3)2= BaCO3↓+ 2NaNO3沉淀A的主要成分是BaSO4、BaCO3。(2)溶液1中含有NaCl、NaNO3、过量的Ba(NO3)2,向其中加入过量的Ag NO3溶液,发生反应:NaCl +Ag NO3= AgCl↓+ NaNO3,离子方程式为:Ag++ Cl—== AgCl↓。(3)①②③中都是分离难溶性固体与液体的操作,均进行的分离操作是过滤。(4)向溶液2中加入过量的Na2CO3溶液,发生反应:Ba(NO3)2+ Na2CO3= BaCO3↓+ 2NaNO3,2AgNO3+ Na2CO3= Ag2CO3↓+ 2NaNO3.所以③中加入过量的Na2CO3溶液的目的是除去Ba2+ 、Ag+。(5)由于③加入过量的Na2CO3溶液,所以3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是Na2CO3,为了除去杂质,可向溶液3中加入适量的稀硝酸。(6)①配制溶液时,称取NaNO3固体的质量是0.5L ×0.40 mol/L×85g/mol=17.0g. 按照操作顺序,第4步是e.转移.②某同学转移溶液的操作如右图所示,图中仪器的名称是烧杯和500mL容量瓶; 该同学操作中的错误是未用玻璃棒引流。
考点:考查杂质的除去、离子方程式的书写、物质的量浓度的溶液的配制步骤、仪器的使用等知识。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有:
工业上制纯碱的方法是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,再将所得碳酸氢钠晶体加热分解后即可得到纯碱(纯碱样品中Na2CO3的质量分数为92%~96%)。涉及到的化学方程式有:
NH3+CO2+H2O → NH4HCO3,NH4HCO3+NaCl(饱和)→ NaHCO3↓+NH4Cl,![]() 。请回答:
。请回答:
(1)工业制得的纯碱中常常含有少量的氯化钠杂质,其主要原因是 。
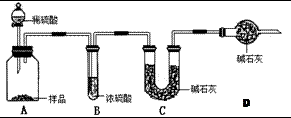
(2)现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计如下方案,请你帮助他们完成如下实验。
甲:用 (填实验仪器)称取10.0g样品,利用上图所示装置,测出反应后装置C中碱石灰增重3.52g。装置D中碱石灰的作用是 。
乙:准确称取10.00g样品后,用 (填实验仪器)配成1000mL溶液,用
式滴定管量取25.00mL放入锥形瓶中,加入2滴酚酞作指示剂,用0.15mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+HCl → NaCl+NaHCO3)。完成三次平行实验后,消耗盐酸体积的平均值为15.00mL。
丙:准确称取10.00g样品后,向其中加入过量的盐酸,充分反应直至样品中无气泡冒出,蒸干混合溶液将所得到固体物质于干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。请分析、计算后填表:
| 分析与计算 分组 | 计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 |
| 失 败 | |
| 乙 |
|
| |
| 丙 |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
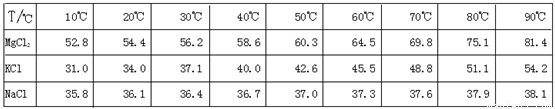
(10分)江苏省拥有很长的海岸线,具有丰富的海洋资源,因此盐化工是本省的一个重要产业。从盐卤初步得到的光卤石(KCl·MgCl2·6H2O)晶体中,还含有约8%的NaCl。
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
并设计出下面的实验流程:
根据他们提供的数据和实验回答下列问题:
问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用
的方法进一步提纯。操作步骤①中趁热过滤的原因是:
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
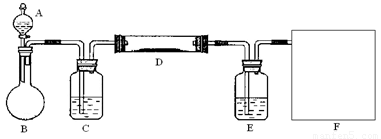
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2·6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别
是 (填写仪器的符号),需要加热的仪器是 (同上)。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。
查看答案和解析>>
科目:高中化学 来源:09-10年建湖二中高二下学期期末考试化学卷 题型:实验题
(10分)江苏省拥有很长的海岸线,具有丰富的海洋资源,因此盐化工是本省的一个重要产业。从盐卤初步得到的光卤石(KCl·MgCl2·6H2O)晶体中,还含有约8%的NaCl。
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
并设计出下面的实验流程:

根据他们提供的数据和实验回答下列问题:
问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用
的方法进一步提纯。操作步骤①中趁热过滤的原因是:
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2·6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别
是 (填写仪器的符号),需要加热的仪器是 (同上)。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com