


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
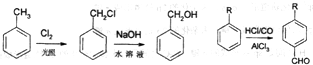 从A出发可发生如图所示的一系列反应,其中G为高分子化合物,化合物B的分子式为C8H8O,当以铁做催化剂进行氯化时,一元取代物只有两种.
从A出发可发生如图所示的一系列反应,其中G为高分子化合物,化合物B的分子式为C8H8O,当以铁做催化剂进行氯化时,一元取代物只有两种.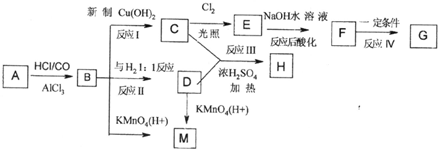
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中,加入过量的2mol?L-1盐酸,再滴加适量l mol?L-1BaCl2溶液. | 有白色沉淀生成,证明待测液中含SO42-. |
| 步骤② | ||
| 步骤③ |
| 序 号 | 所取Na2SO3溶液的体积 | 终点消耗KMnO4溶液的体积 |
| 1 | 25.00ml | 20.02ml |
| 2 | 25.00ml | 21.80ml |
| 3 | 25.00ml | 19.98ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.005mol?L-1 |
| B、0.08mol?L-1 |
| C、0.125mol?L-1 |
| D、0.25mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容,请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容后摇匀,发现液面低于刻度线,再加水至刻度线 |
| B、转移液体后未洗涤烧杯 |
| C、在容量瓶中进行定容时,俯视刻度线 |
| D、配制前洗涤好的容量瓶内有少量水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(毫克) | 255 | 385 | 459 |
| 生成气体体积(毫升) | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 品名 | ***蔬菜苏打饼 |
| 配料 | 面粉、鲜鸡蛋、精炼食用植物油、白砂糖、奶油、食盐、脱水青菜、橙汁 |
| 保质期 | 十二个月 |
| 生产日期 | 2014年1月20日 |
| A、富含蛋白质的是鸡蛋 |
| B、富含维生素的是脱水青菜和橙汁 |
| C、富含糖类的物质只有白砂糖 |
| D、富含油脂的是精炼食用植物油和奶油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com