
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(毫克) | 255 | 385 | 459 |
| 生成气体体积(毫升) | 280 | 336 | 336 |
| V |
| Vm |
| n |
| c |
| 336mL |
| 280mL |
| 0.336L |
| 22.4L/mol |
| 0.03mol |
| 0.03L |
| 0.28L |
| 22.4L/mol |
| 0.459g |
| 0.255g |
| 0.039mol |
| 1mol/L |


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
| 元素 | 最外层电子数 | 次外层电子数 |
| D | X | X+4 |
| E | X+1 | X+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
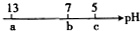 已知二元含氧酸H2X易溶于水,向1.0mol?L-1 的酸式盐NaHX中滴入几滴石蕊试剂,溶液变红.下列说法错误的是( )
已知二元含氧酸H2X易溶于水,向1.0mol?L-1 的酸式盐NaHX中滴入几滴石蕊试剂,溶液变红.下列说法错误的是( )| A、NaHX溶液呈酸性 |
| B、若上述溶液中检测不到HX-,则NaHX溶于水时的电离方程式为:NaHX=Na++H++X- |
| C、若上述溶液中检测不到H2X,但能检测到HX-,则NaHX溶于水时,水的电离程度增大 |
| D、若上述溶液中能检测到H2X,则此时溶液中c(X2-)>c(H2X) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①④⑥ |
| C、②③④ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B、逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C、正、逆反应速率都减小,平衡向逆反应方向移动 |
| D、正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由分子构成的物质中一定含有共价键 |
| B、正四面体结构的分子中键角一定是109028’ |
| C、形成共价键的元素不一定是非金属元素 |
| D、CO2 和SiO2都是直线型分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com