
分析 (1)A元素原子核外M层电子数是L层电子数的$\frac{1}{2}$,则M层电子数为4,由电子排布规律可知原子的电子数,然后根据核内质子数=核外电子数来解答;
(2)B元素的原子最外层电子是次外层电子的1.5倍,原子只能有2个电子层,最外层电子数为2×1.5=3,由电子排布规律可知原子的电子数,然后根据核内质子数=核外电子数来解答;
(3)C元素的次外层电子数是最外层电子数的$\frac{1}{4}$,则次外层电子数只能为2,由电子排布规律可知原子的电子数,然后根据核内质子数=核外电子数来解答;
(4)K层最多排2个电子,M层电子数是K层电子数的3倍,所以M层排6个电子,据此分析解答.
解答 解:(1)A元素原子核外M层电子数是L层电子数的$\frac{1}{2}$,则M层电子数为4,原子各层电子数分别为2、8、4,为Si元素,故答案为:Si;
(2)B元素的原子最外层电子是次外层电子的1.5倍,原子只能有2个电子层,最外层电子数为2×1.5=3,原子各层电子数分别为2、3,则B为B元素,故答案为:B;
(3)C元素的次外层电子数是最外层电子数的$\frac{1}{4}$,则次外层电子数只能为2,则最外层电子数为8,核外电子数为2+8=10,则核内质子数=核外电子数来,该元素为Ne,故答案为:Ne;
(4)K层最多排2个电子,M层电子数是K层电子数的3倍,所以M层排6个电子,所以该元素核外有2+8+6=16个电子,原子中原子序数=核外电子数,所以该元素的16号元素S,故答案为:S.
点评 本题考查了原子核外电子的排布,难度不大,明确电子的排布规则是解本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 四种离子都具有相同的电子层结构 | |
| B. | 原子半径:r(D)>r(C)>r(A)>r(B) | |
| C. | 离子半径:r(B+)>r(A2+)>r(C3-)>r(D-) | |
| D. | B、D两元素的最高价氧化物的水化物在溶液中反应的离子方程式可表示为H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T具有相同的质子数,是氢元素的三种同位素 | |
| B. | OH-与H3O+组成元素相同,所含质子数相同 | |
| C. | 结构示意图为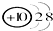 和 和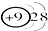 两种粒子为同一种元素 两种粒子为同一种元素 | |
| D. | 元素原子最外层电子数的多少是判断金属性和非金属性强弱的依据 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对该反应体系加热 | B. | 不用稀硫酸,改用98%的浓硫酸 | ||
| C. | 加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
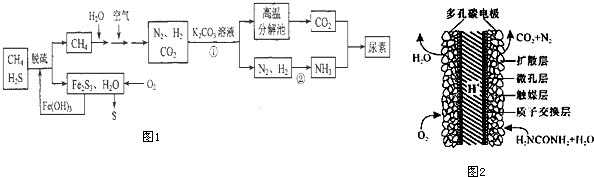
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com