
【题目】往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。下列说法不正确的是
A. 该实验表明SO2有漂白性 B. 白色沉淀为BaSO4
C. 该实验表明FeCl3有氧化性 D. 反应后溶液酸性增强
科目:高中化学 来源: 题型:
【题目】亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如图: ![]()
(1)Co2+基态核外电子排布式为 .
(2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为(填元素符号);配离子 1Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 .
(3)与NO2﹣互为等电子体的单质分子为(写化学式).
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 .
(5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图 ![]() 所示,1molNDMA分子中含有σ键的数目为mol.
所示,1molNDMA分子中含有σ键的数目为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示:
已知Y的最高价氧化物对应的水化物可与其简单氢化物反应可生成离子型晶体的一种盐;Z是地壳中含量最多的元素;W原子的最外层电子数与Ne原子的最外层电子数相差1;U原子最外层电子数是次外层电子数的两倍;V为原子核内有12个中子的二价金属,当2.4克V与足量热水反应时,在标准状况下放出气体2.24L;请回答下列问题:
(1)指出Y元素在周期表中的位置;
(2)写出W的简单离子的结构示意图;
(3)比较W的气态氢化物与H2S和HF的稳定性(由强到弱):
(4)由W、Y两种元素组成的一种化合物,每个原子最外层均达到8电子稳定结构,写出该化合物的电子式;
(5)UZ2的结构式为
(6)由X、Y、Z三种元素组成的化合物,是一种常见的化肥,其原子个数比为4:2:3,则该物质含有的化学键类型为;
(7)V与W两元素最高价氧化物的水化物反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.HClO溶于水能电离,破坏了H—O键和O—Cl键
B.CaCl2晶体中存在共价键
C.SiO2属于原子晶体,熔化破坏共价键和分子间作用力
D.NH4Cl受热分解既破坏了离子键,也破坏了共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途描述正确且具有对应关系的是
A.浓硫酸具有脱水性,可用作某些气体的干燥剂
B.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
C.SO2具有还原性,可用作草帽、纸浆的漂白剂
D.12C的放射性,可用作考古断代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X,Y,Z,W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( ) 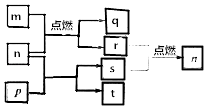
A.Y,Z,W的简单离子的电子层结构相同
B.原子半径:r(X)<r(Y)<r(Z)<r(W)
C.简单氢化物的稳定性:X>Y
D.Y与Z两种元素形成的化合物一定只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属的说法正确的是
A.金属原子只有还原性,金属阳离子只有氧化性 B.金属单质在常温下都是固体
C.金属阳离子被还原不一定得到金属单质 D.含金属元素的离子都是阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用甲烷制乙酸乙酯,欲使其原子利用率达到最高,还需要消耗的其他反应物是( )
A. CO B. CO2和H2O C. H2O和O2 D. CH3OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com