
(16分)氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变; B.混合气体的颜色不再变化; C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
(16分)(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ/mol(3分)
(2)(7分)①6.67 (3分) ②A(2分) ③< (2分)
(3)(6分)①NH4+ (3分) ②c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)(3分)
【解析】
试题分析:(1)根据题意可得热化学方程式:C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ/mol;①根据图像和题意可知,在298k时,该反应达到平衡时,c(N2O4)=0.6mol/L, c(NO2)=0.3mol/L,所以该反应的平衡常数为K= L /mol; ②A.由于反应是在恒容的密闭容器内减小的,所以在任何时刻都存在混合气体的密度保持不变,一般不能判断反应达到平衡状态,错误; B.由于容器的容积不变,若混合气体的颜色不再变化,说明物质的浓度不变,反应达到平衡状态,正确; C.该反应的气体体积减小的反应,若未达到平衡状态,则气体的压强就会发生变化,因此气压恒定时,则反应处于平衡状态,正确。故选项是A;③若反应在298K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则由于物质的浓度不变,但是该反应的正反应是放热反应,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,即平衡逆向移动所以V(正)<V(逆);(3)①NH4HSO4是强酸弱碱盐,弱碱阳离子NH4+水解消耗水电离产生的OH-,使溶液显酸性,而且NH4HSO4是强酸的酸式盐,电离也产生H+,使溶液显酸性。b点时,溶液中发生水解反应的离子是NH4+;②在c点时溶液呈中性,c(OH-)=c(H+),n(Na+)=0.015mol;n(SO)=0.01mol,由于NH4+会发生水解反应而消耗,所以n(NH4+)< 0.01mol,因为溶液的体积是相同的,所以微粒的物质的量越多,离子浓度就越大,因此c(Na+)> c(SO)>c(NH),在溶液中水电离程度很小,所以c(OH-)、c(H+)都很小,远小于盐电离产生的离子浓度,因此溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)。
L /mol; ②A.由于反应是在恒容的密闭容器内减小的,所以在任何时刻都存在混合气体的密度保持不变,一般不能判断反应达到平衡状态,错误; B.由于容器的容积不变,若混合气体的颜色不再变化,说明物质的浓度不变,反应达到平衡状态,正确; C.该反应的气体体积减小的反应,若未达到平衡状态,则气体的压强就会发生变化,因此气压恒定时,则反应处于平衡状态,正确。故选项是A;③若反应在298K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则由于物质的浓度不变,但是该反应的正反应是放热反应,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,即平衡逆向移动所以V(正)<V(逆);(3)①NH4HSO4是强酸弱碱盐,弱碱阳离子NH4+水解消耗水电离产生的OH-,使溶液显酸性,而且NH4HSO4是强酸的酸式盐,电离也产生H+,使溶液显酸性。b点时,溶液中发生水解反应的离子是NH4+;②在c点时溶液呈中性,c(OH-)=c(H+),n(Na+)=0.015mol;n(SO)=0.01mol,由于NH4+会发生水解反应而消耗,所以n(NH4+)< 0.01mol,因为溶液的体积是相同的,所以微粒的物质的量越多,离子浓度就越大,因此c(Na+)> c(SO)>c(NH),在溶液中水电离程度很小,所以c(OH-)、c(H+)都很小,远小于盐电离产生的离子浓度,因此溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)。
考点:考查热化学方程式的书写、化学平衡状态的判断、化学平衡常数的计算、温度对化学平衡移动的影响、盐的水解、溶液中离子浓度的大小比较的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014秋季甘肃省白银市高二第一学期期中理科化学试卷(解析版) 题型:选择题
一定条件下体积不变的密闭容器中,反应2A(g)+2B(g) 3C(g)+D(g)达到平衡状态的标志是
3C(g)+D(g)达到平衡状态的标志是
A.单位时间内生成2n mol A,同时生成n mol D
B.容器内压强不随时间而变化
C.单位时间内生成n mol B,同时消耗1.5n mol C
D.容器内混合气体密度不随时间而变化
查看答案和解析>>
科目:高中化学 来源:2014秋季湖南省高二上学期第一次阶段测试化学(B)试卷(解析版) 题型:选择题
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H2(g)+O2(g) == 2H2O(1),△H=―285.8kJ/mol
B.2H2(g)+ O2(g) == 2H2O(1),△H=+571.6 kJ/mol
C.2H2(g)+O2(g) == 2H2O(g),△H=―571.6 kJ/mol
D.H2(g)+ O2(g) == H2O(1),△H=―285.8kJ/mol
O2(g) == H2O(1),△H=―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市十校高三10月联考化学试卷(解析版) 题型:实验题
(16分)实验室里通常用MnO2与浓盐酸反应制取氯气。现用下列有关装置先制取干燥、纯净的氯气。后进行有关性质实验。试根据下列有关装置回答有关问题。
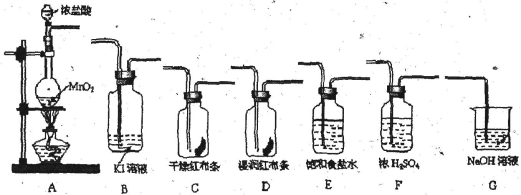
(1)上述装置中各仪器从左至右的连接顺序为A接_ _接_ _接_ _接_ _接_ _接G。
(2)E装置的作用是________ __,D中的现象为___ _ ,B中的现象为_________。
(3)写出相关反应的离子方程式:A中____ ____ ___,G中_____________ _。
(4)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的混合液,反应的化学方程式是______________________________________。
(5) 报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市十校高三10月联考化学试卷(解析版) 题型:选择题
以下进行性质比较的实验设计,合理的是( )
A.用NaOH溶液与FeCl3溶液制备Fe(OH)3胶体
B.比较氯、溴非金属性:氯气通入溴化钠溶液中
C.将混有SO2的CO2通入NaOH溶液中除去SO2
D.比较镁、铝金属性:镁、铝(除氧化膜)分别放入4mol·L-1NaOH溶液中
查看答案和解析>>
科目:高中化学 来源:2015届广东省肇庆市高三一模理综化学试卷(解析版) 题型:选择题
西维因是一种高效低毒杀虫剂,在碱性条件下可水解:

则下列说法正确的是
A.西维因是一种芳香烃
B.西维因分子中所有碳原子一定共面
C.可用FeCl3溶液检验西维因是否发生水解
D.在Ni催化下1mol西维因最多能与6molH2加成
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市毕业班调研测试理综化学试卷(解析版) 题型:实验题
(16分)净水剂液体聚合硫酸铝铁兼具铁盐和铝盐的双重絮凝特性,一般是以铁盐为主,铝盐为辅。现用的铝土矿(其主要成分是Al2O3,含有少量杂质Fe2O3和SiO2,其他杂质忽略不计)来制备该净水剂,其工艺流程如下:
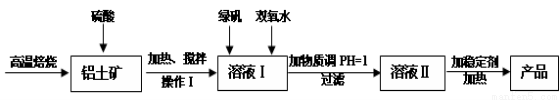
(1)H2SO4浓度的适宜范围是45%~50%,反应的适宜温度是100℃,其目的是: ;Al2O3与H2SO4反应的化学反应方程式是__________。
(2)操作I为:冷却静置、 、洗涤,所得到的溶液I中的金属阳离子有_______(填化学式)。
(3)溶液I中加入绿矾(FeSO4·7H2O)和双氧水的目的是: ,涉及的反应离子方程式为 _ _。
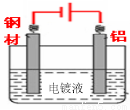
(4)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,请在答题卡中完成钢材镀铝的装置示意图,并作相应标注。
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:选择题
用下图表示的一些物质或概念间的关系不正确的是
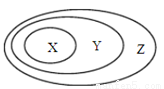
| X | Y | Z |
A. | 酸 | 化合物 | 纯净物 |
B. | 电解质 | 盐 | 化合物 |
C. | 胶体 | 分散系 | 物质 |
D. | 碱性氧化物 | 氧化物 | 化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com