
【题目】回答下列问题
(1)反应mA(g)+nB(g)![]() pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
压强/Pa | 2×105 | 4×105 | 8×105 |
c(A)/mol·L-1 | 0.10 | 0.20 | 0.44 |
分析表中数据可知:m、n、p的关系是:m+n______p(填>、=或<)。当压强从4×105 Pa增加到8×105Pa时,该反应的化学平衡________(填“向左”“向右”或“不”)移动,可能的原因是_____________________________________________。
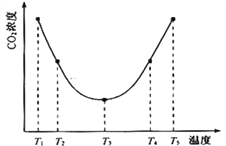
(2)利用反应:(NH4)2CO3(aq)+H2O(l)+ CO2(g)![]() 2NH4HCO3(aq) △H = akJ/mol 可以用(NH4)2CO3溶液捕获CO2以减小温室效应。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),测定容器中CO2气体的浓度。在其它实验条件不变、时间间隔相同时,测得容器中CO2气体浓度随温度的变化趋势图如下:则△H______0(填>、=或<)。在T3前后容器内CO2气体浓度呈现如图变化趋势的原因是___________________________。
2NH4HCO3(aq) △H = akJ/mol 可以用(NH4)2CO3溶液捕获CO2以减小温室效应。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),测定容器中CO2气体的浓度。在其它实验条件不变、时间间隔相同时,测得容器中CO2气体浓度随温度的变化趋势图如下:则△H______0(填>、=或<)。在T3前后容器内CO2气体浓度呈现如图变化趋势的原因是___________________________。
(3)某温度下,水的离子积KW = 1.0×10-12,现将100体积pH=a的H2SO4溶液和1体积pH=b的NaOH溶液混合使之呈中性,则a + b = __________。
【答案】 = 向左 反应物B在此压强下已由气态转化为液态 < 在T3前反应未达平衡,升高温度化学反应速率加快,CO2的捕获量增加,T3后反应达平衡,升高温度化学平衡逆向移动,CO2的捕获量减小 14
【解析】试题分析:根据表格数据,压强从2×105增大到4×105,体积缩小一倍,c(A)从0.2增大到0.2,也增大一倍,说明平衡没移动;当压强从4×105 Pa增加到8×105Pa时,c(A)从0.2增大到0.44,浓度的变化大于2倍,说明平衡逆向移动;(2)由图可知,当温度为T3时,可逆反应达到平衡状态,温度升高,CO2的浓度逐渐增大,说明平衡逆向移动;②在T1~T3区间,此时可逆反应未达到平衡,温度升高,化学反应速率加快,反应正向进行,CO2的捕获量随温度的升高而提高 。(3)溶液混合后呈中性,根据![]() 计算;
计算;
解析:根据表格数据,压强从2×105增大到4×105,体积缩小一倍,c(A)从0.2增大到0.2,也增大一倍,说明平衡没移动,加压平衡不移动,说明气体系数和不变,故m+n=p;当压强从4×105 Pa增加到8×105Pa时,c(A)从0.2增大到0.44,浓度的变化大于2倍,说明平衡逆向移动,说明气体系数和不相同,则反应物B在此压强下已由气态转化为液态;(2)由图可知,当温度为T3时,可逆反应达到平衡状态,温度升高,CO2的浓度逐渐增大,说明平衡逆向移动,则△H<0;②在T3前反应未达平衡,升高温度化学反应速率加快,CO2的捕获量增加,T3后反应达平衡,升高温度化学平衡逆向移动,CO2的捕获量减小。(3)KW = 1.0×10-12, pH=a的H2SO4溶液中![]() 、pH=b的NaOH溶液
、pH=b的NaOH溶液![]() ;
; ![]() ,
, ![]() ;则a + b =14。
;则a + b =14。


科目:高中化学 来源: 题型:
【题目】下列有关实验的说法中正确的是
A.蒸馏时,温度计的水银球应伸入液面下
B.在持续加热的情况下,向蒸馏烧瓶内补加碎瓷片
C.重结晶时,趁热过滤的目的是减少被提纯物质的损失
D.在萃取实验中,可以用乙醇萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸是常用的干燥剂,都能用浓硫酸干燥的一组气体是( )
A. CH4、H2、CO、NH3 B. CO2、H2、SO2、Cl2
C. CO、CH4、HCl、HBr D. SO2、CO2、H2、H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温家宝总理在2010年政府工作报告中提出:“要大力开发低碳技术,推广高效节能技术,积极发展新能源和可再生能源。”下列有关做法与此不相符的是
A.大力开发丰富的煤炭资源,减少对石油的依赖
B.回收废弃饮料包装纸,制作成公园内的休闲长椅
C.在西部和沿海地区兴建风力发电站,解决能源问题
D.鼓励购买小排量汽车,推广与发展电动、混合动力汽车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】玻尔理论不能解释( )
A.氢原子光谱为线状光谱
B.在一给定的稳定轨道上运动的核外电子不辐射能量
C.氢原子的可见光区谱线
D.有外加磁场作用时氢原子光谱有多条谱线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3。
②5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(2)沉淀反应的离子方程式是______________。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积31.60 mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为______。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如下图,其变化趋势的原因可能为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,对于可逆反应A(?)+3B(?)![]() 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是( )
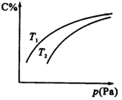
A. 若正反应方向ΔH<0,则T1>T2
B. 压强增大时,混合气体的平均相对分子质量减小
C. B一定为气体
D. A一定为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)溶液中存在反应:H3BO3(aq)+H2O(l) ![]() [B(OH)4]-(aq)+H+(aq)。结合下表,下列说法正确的是( )
[B(OH)4]-(aq)+H+(aq)。结合下表,下列说法正确的是( )
化学式 | 硼酸 | 碳酸 | 醋酸 |
电离常数(298 K) | K=5.7×10-10 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
A. 将少量醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
B. 往碳酸钠溶液加入过量硼酸,没有明显变化,说明没有发生反应
C. 硼酸是三元弱酸,酸性比碳酸强
D. 等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com