
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3。
②5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(2)沉淀反应的离子方程式是______________。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积31.60 mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为______。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如下图,其变化趋势的原因可能为________。

【答案】 NH3H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解 Fe2+ + 2NH3·H2O = Fe(OH)2↓+ 2NH4+ 0.0108 mol
由题意知氧化C2O42-和Fe2+共消耗0.2000 mol·L-1标准KMnO4溶液体积31.60 mL,步骤3、4标准KMnO4溶液只氧化Fe2+消耗KMnO4溶液体积10.00mL,所以C2O42-消耗KMnO4溶液体积为(31.60-10.00)=21.60mL,由5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O得5C2O42-~2MnO4-,所以C2O42-的物质的量为21.60×10-3×0.2000×5/2=0.0108mol 生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快
【解析】本题考查化学工艺流程,(1)沉淀过程中加入NH3·H2O,NH3·H2O不稳定,受热易分解,根据信息①,得出沉淀发生的反应是Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+,氢氧化亚铁受热易分解,因此温度控制在40℃,目的是NH3H2O受热易分解,挥发出NH3,Fe(OH)2受热易分解;(2)根据上述分析,得出离子反应方程式为:Fe2+ + 2NH3·H2O = Fe(OH)2↓+ 2NH4+;(3)根据信息②,草酸亚铁都能与高锰酸钾溶液发生反应,步骤2:氧化C2O42-和Fe2+共消耗0.2000 mol·L-1标准KMnO4溶液体积31.60 mL,步骤3:发生Zn+2Fe3+=2Fe2++Zn2+,步骤4:高锰酸钾溶液只与Fe2+发生氧化还原反应,此时消耗高锰酸钾溶液的体积为10.00mL,即C2O42-消耗高锰酸钾的体积为(31.60-10.00)mL=21.60mL,根据5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O,C2O42-的物质的量为21.60×10-3×0.2000×5/2=0.0108mol;(4)可能原因是生成的Mn2+作催化剂,随着Mn2+浓度增加,反应速率越来越快。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】类比是重要的化学学科方法,类比pH的定义可定义pOH 和pKW。在水的电离平衡中,c(H+)和c(OH-)的关系如图所示,则下列说法不正确的是:
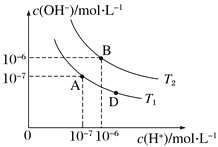
A. 图中温度T2>25 ℃
B. 位于AB直线上任意点的溶液均有c(H+)= ![]()
C. 位于AB直线上任意点的溶液均有pH=pOH =![]()
D. 图中D点处的溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+ 2H2(g)![]() CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
(1)该反应为_________________反应(填“吸热”“放热”).
(2)假设该反应在恒容绝热的密闭容器中进行,下列能判断该反应已达化学平衡状态的是________ ;
A.容器中压强不变 B.混合气体中c(CO)不变 C.2v正(H2)=v逆(CO)
D.容器中混合气体的密度不变 E.容器内温度不变 F.c(CO):c(H2):c(CH3OH)=1:2:1
(3)若某温度下,该反应达到平衡时测得反应物与生成物的浓度为c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1, 则此时的温度___________;
A.小于250℃ B.在250℃~300℃之间 C.在300℃~350℃之间 D.大于350℃
(4)某温度下,在体积固定的1L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15 min,用H2表示的平均反应速率为V(H2)=______________ mol·L-1·min -1,达到平衡时CO的转化率为_____________,该温度下该反应的平衡常数为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)反应mA(g)+nB(g)![]() pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
压强/Pa | 2×105 | 4×105 | 8×105 |
c(A)/mol·L-1 | 0.10 | 0.20 | 0.44 |
分析表中数据可知:m、n、p的关系是:m+n______p(填>、=或<)。当压强从4×105 Pa增加到8×105Pa时,该反应的化学平衡________(填“向左”“向右”或“不”)移动,可能的原因是_____________________________________________。
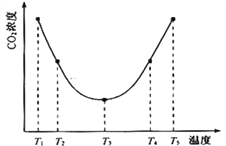
(2)利用反应:(NH4)2CO3(aq)+H2O(l)+ CO2(g)![]() 2NH4HCO3(aq) △H = akJ/mol 可以用(NH4)2CO3溶液捕获CO2以减小温室效应。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),测定容器中CO2气体的浓度。在其它实验条件不变、时间间隔相同时,测得容器中CO2气体浓度随温度的变化趋势图如下:则△H______0(填>、=或<)。在T3前后容器内CO2气体浓度呈现如图变化趋势的原因是___________________________。
2NH4HCO3(aq) △H = akJ/mol 可以用(NH4)2CO3溶液捕获CO2以减小温室效应。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),测定容器中CO2气体的浓度。在其它实验条件不变、时间间隔相同时,测得容器中CO2气体浓度随温度的变化趋势图如下:则△H______0(填>、=或<)。在T3前后容器内CO2气体浓度呈现如图变化趋势的原因是___________________________。
(3)某温度下,水的离子积KW = 1.0×10-12,现将100体积pH=a的H2SO4溶液和1体积pH=b的NaOH溶液混合使之呈中性,则a + b = __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2在70℃的NaOH溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3物质的量之比为4:1,溶液中NaCl与NaClO的物质的量之比为( )
A.11:2B.1:1C.9:4D.5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.烃分子中所含碳氢键数目一定为偶数
B.塑料、橡胶和纤维都属于合成高分子材料
C.乙烯和苯都能使溴水褪色,其褪色原理相同
D.淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物命名中常使用三套数字,甲、乙、丙…,1、2、3…,一、二、三…。其中“一、二、三…”指的是( )
A.碳原子数B.氢原子数C.碳链位置编号D.某种基团的数目
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3He与4He互为同位素,下列说法不正确的是
A. 3He与4He具有相同的质子数 B. 3He与4He具有相同的中子数
C. 3He与4He具有相同的最外层电子数 D. 3He与4He具有不同的质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B. 没有单质参加的反应一定不是氧化还原反应
C. 置换反应一定是氧化还原反应
D. 失电子难的原子,容易获得电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com