
【题目】类比是重要的化学学科方法,类比pH的定义可定义pOH 和pKW。在水的电离平衡中,c(H+)和c(OH-)的关系如图所示,则下列说法不正确的是:
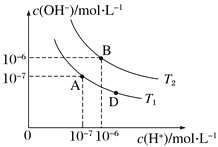
A. 图中温度T2>25 ℃
B. 位于AB直线上任意点的溶液均有c(H+)= ![]()
C. 位于AB直线上任意点的溶液均有pH=pOH =![]()
D. 图中D点处的溶液显碱性
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】我国古代中药学著作《新修本草》中关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色。”明末学者方以智所著《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽术不茂。”下列有关叙述正确的是
A. 赤色固体可能是Fe2O3 B. “青矾厂气“可能是CO和CO2
C. 青矾可能是NH4Al(SO4)2·12 H2O D. 青矾宜密闭贮藏,防止还原变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在2000年8月10日出版的英国《自然》杂志上报告,他们用DNA制造出了一种臂长只有7nm的纳米级镊子,以便能够钳起分子或原子并对它们随意组合。下列分散系中的分散质的粒子直径与纳米镊子具有相同数量级的是( )。
A.溶液 B.胶体 C.悬浊液 D.乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)在一定条件下将CO2和H2转化为甲醇蒸气和水蒸气的相关反应有:
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H1=+41kJ/mol
CO(g)+H2O(g) △H1=+41kJ/mol
CO(g)+2 H2(g)![]() CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
则由CO2和H2转化为甲醇蒸气和水蒸气的热化学方程式为____________________。
(2)在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应CO2(g)+3H(g)2![]() CH3OH(g)+H2O(g) △H3<0.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H3<0.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①能说明该反应已达平衡状态的是______________。
A.单位时间内有n molH—H键断裂,同时又n mol O—H键生成
B.混合气体的密度不随时间变化
C.体系中n(CO2)/n(H2)=1∶1,且保持不变
D.CO2的体积分数在混合气体中保持不变
②下列措施能使n(CH3OH)/n(CO2)增大的是__________。
A.升高温度
B.恒温恒容下,再充入2molCO2、3molH2
C.使用高效催化剂
D.恒温恒容充入He(g)
③计算该温度下此反应的平衡常数K=__________(L/mol)2(保留3位有效数字);若使K的值变为1,则应采取的措施是___________。
A.增大压强 B.恒压加入一定量H2
C.升高温度 D.降低温度
(3)捕捉CO2可以利用Na2CO3溶液。用100mL 0.1mol/LNa2CO3溶液完全捕捉224mL(己换算为标准状况,溶液体积变化忽略不计)CO2气体,所得溶液显_________性(填酸,碱,中):且c(HCO3-)+c(CO32-)+c(H2CO3)=__________mol/L(填数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是__________,该反应的化学方程式是__________。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是__________。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是_________ (填所在周期和族);Y的化学式是__________________。
②含a mol x的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是_________mol。
(4)若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色,则A与B按物质的量之比1∶4恰好反应后,溶液中离子浓度从大到小的顺序是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1 mol O2和1 mol N2所占的体积都约为22.4 L
B.H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L
D.在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的N的物质的量约2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法中正确的是
A.蒸馏时,温度计的水银球应伸入液面下
B.在持续加热的情况下,向蒸馏烧瓶内补加碎瓷片
C.重结晶时,趁热过滤的目的是减少被提纯物质的损失
D.在萃取实验中,可以用乙醇萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3。
②5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(2)沉淀反应的离子方程式是______________。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积31.60 mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为______。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如下图,其变化趋势的原因可能为________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com