
【题目】中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:
(1)若Y是黄绿色气体,则Y的电子式是__________,该反应的化学方程式是__________。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是__________。
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是_________ (填所在周期和族);Y的化学式是__________________。
②含a mol x的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是_________mol。
(4)若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色,则A与B按物质的量之比1∶4恰好反应后,溶液中离子浓度从大到小的顺序是__________________
【答案】 ![]() MnO2+4HCl(浓)
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 4∶1 第4周期Ⅷ族 NO 0.4a c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+)
MnCl2+Cl2↑+2H2O 4∶1 第4周期Ⅷ族 NO 0.4a c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+)
【解析】试题分析:(1)因黄绿色气体为氯气,氯原子最外层7个电子,则氯气中存在一对共用电子对,其电子式为![]() ,A、B的物质的量之比为1:4,则反应为MnO2+4HCl(浓)
,A、B的物质的量之比为1:4,则反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;(2)A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,若为2个电子层,则第一层电子数为2,第二层电子数为4,其质子数等于电子数等于6,即A为碳元素,A、B的物质的量之比为1:4,则该反应为碳与浓硝酸反应,其反应为C+4HNO3═CO2↑+4NO2↑+2H2O,由化合价可知碳元素的化合价升高,则碳作还原剂,硝酸中氮元素的化合价降低,则硝酸作氧化剂,由化学计量数可知氧化剂与还原剂的物质的量之比为4:1;
MnCl2+Cl2↑+2H2O;(2)A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,若为2个电子层,则第一层电子数为2,第二层电子数为4,其质子数等于电子数等于6,即A为碳元素,A、B的物质的量之比为1:4,则该反应为碳与浓硝酸反应,其反应为C+4HNO3═CO2↑+4NO2↑+2H2O,由化合价可知碳元素的化合价升高,则碳作还原剂,硝酸中氮元素的化合价降低,则硝酸作氧化剂,由化学计量数可知氧化剂与还原剂的物质的量之比为4:1;
(3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水;①铁为26号元素,在在元素周期表中的第4周期Ⅷ族,铁与稀硝酸反应生成的Y为NO;②设被还原的硝酸铁的物质的量为x,则
2Fe3++Fe═3Fe2+,
2 3
x 3x/2
由溶液中两种金属阳离子的物质的量恰好相等,则a-x=3x/2,解得x=0.4a;
(4)向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,B的焰色为黄色, 则B中含有钠元素,A与B按物质的量之比1:4恰好反应,则该反应为氯化铝与氢氧化钠的反应,其反应为AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,显然若A与B的物质的量分别为1mol、4mol,则钠离子4mol, 氯离子3mol,偏绿酸根离子略小于1mol,因偏铝酸根离子水解则溶液显碱性,即c(OH-)>c(H+),则离子大小为c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+)。


科目:高中化学 来源: 题型:
【题目】类比是重要的化学学科方法,类比pH的定义可定义pOH 和pKW。在水的电离平衡中,c(H+)和c(OH-)的关系如图所示,则下列说法不正确的是:
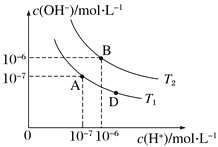
A. 图中温度T2>25 ℃
B. 位于AB直线上任意点的溶液均有c(H+)= ![]()
C. 位于AB直线上任意点的溶液均有pH=pOH =![]()
D. 图中D点处的溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列叙述正确的是:
A. 1L0.1 mol·L-1NaHCO3溶液中含有0.1 NA个HCO3-
B. 0.1 mol Cl2参加化学反应,转移电子数目一定为0.2 NA
C. 常温常压下,28g N2和CO混合气体中含有原子总数为2NA
D. 足量Na与1 molO2加热反应,转移电子总数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生以酚酞为指示剂用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 27.45 |
第二次 | 25.00 | 0.00 | 30.30 |
第三次 | 25.00 | 0.00 | 27.55 |
下列说法正确的是:
A. 当溶液从无色刚好变成红色时,则滴定终点达到
B. 该氢氧化钠溶液中c(NaOH)=0.110 0 mol·L-1
C. .滴定达终点时,滴定管尖嘴有悬液,则测定结果偏低
D. 实验中锥形瓶应用待测氢氧化钠溶液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2 (g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.烃分子中所含碳氢键数目一定为偶数
B.塑料、橡胶和纤维都属于合成高分子材料
C.乙烯和苯都能使溴水褪色,其褪色原理相同
D.淀粉、葡萄糖、脂肪和蛋白质在一定条件下都能发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com