
【题目】已知:CO(g)+ 2H2(g)![]() CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
(1)该反应为_________________反应(填“吸热”“放热”).
(2)假设该反应在恒容绝热的密闭容器中进行,下列能判断该反应已达化学平衡状态的是________ ;
A.容器中压强不变 B.混合气体中c(CO)不变 C.2v正(H2)=v逆(CO)
D.容器中混合气体的密度不变 E.容器内温度不变 F.c(CO):c(H2):c(CH3OH)=1:2:1
(3)若某温度下,该反应达到平衡时测得反应物与生成物的浓度为c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1, 则此时的温度___________;
A.小于250℃ B.在250℃~300℃之间 C.在300℃~350℃之间 D.大于350℃
(4)某温度下,在体积固定的1L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15 min,用H2表示的平均反应速率为V(H2)=______________ mol·L-1·min -1,达到平衡时CO的转化率为_____________,该温度下该反应的平衡常数为_______(保留两位小数)。
【答案】 放热. ABE A 0.04 45% 0.68(保留两位小数)
【解析】试题分析:(1)升高温度,平衡常数减小,平衡逆向移动;(2)根据化学平衡状态的特征判断;(3)平衡时测得反应物与生成物的浓度为c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1,计算平衡常数,根据平衡常数判断温度;(4)根据压强比等于物质的量比, 利用“三段式”计算15 min时氢气的物质的量,根据![]() 计算氢气的反应速率;20 min时压强保持不变,达到平衡状态,利用“三段式”计算平衡时的物质的量,再计算CO的转化率、平衡常数;
计算氢气的反应速率;20 min时压强保持不变,达到平衡状态,利用“三段式”计算平衡时的物质的量,再计算CO的转化率、平衡常数;
解析:(1)升高温度,平衡常数减小,平衡逆向移动,所以正反应放热;
(2)A.该反应物质的量、温度都改变,所以压强是变量,容器中压强不变一定平衡,故A正确;; B.根据平衡定义,混合气体中c(CO)不变一定平衡,故B正确; C.正逆反应速率比等于系数比达到平衡状态,所以v正(H2)=2v逆(CO) 达到平衡状态,故C错误;
D.根据![]() ,容器体积、气体质量都不变,所以密度是恒量,容器中混合气体的密度不变不一定平衡,故D错误; E、反应放热,温度是变量,容器内温度不变一定平衡,故E正确; F、c(CO):c(H2):c(CH3OH)=1:2:1时,浓度不一定保持不变,故F错误。
,容器体积、气体质量都不变,所以密度是恒量,容器中混合气体的密度不变不一定平衡,故D错误; E、反应放热,温度是变量,容器内温度不变一定平衡,故E正确; F、c(CO):c(H2):c(CH3OH)=1:2:1时,浓度不一定保持不变,故F错误。
(3)平衡时c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1,则![]() > 2.041,根据平衡常数,温度小于250℃,故A正确;(4)根据压强比等于物质的量比,15 min时气体总物质的量是
> 2.041,根据平衡常数,温度小于250℃,故A正确;(4)根据压强比等于物质的量比,15 min时气体总物质的量是![]()

1-x+2-2x+x=2.4
x=0.3mol
根据![]() ,氢气的反应速率
,氢气的反应速率![]() mol·L-1·min -1 ;20 min时压强保持不变,达到平衡状态,根据压强比等于物质的量比,20 min时气体总物质的量是
mol·L-1·min -1 ;20 min时压强保持不变,达到平衡状态,根据压强比等于物质的量比,20 min时气体总物质的量是![]()
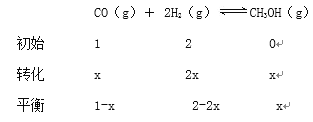
1-x+2-2x+x=2.1
x=0.45
CO的转化率=![]() ;
;
平衡常数![]() 0.68 ;
0.68 ;


科目:高中化学 来源: 题型:
【题目】科学家在2000年8月10日出版的英国《自然》杂志上报告,他们用DNA制造出了一种臂长只有7nm的纳米级镊子,以便能够钳起分子或原子并对它们随意组合。下列分散系中的分散质的粒子直径与纳米镊子具有相同数量级的是( )。
A.溶液 B.胶体 C.悬浊液 D.乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.1 mol O2和1 mol N2所占的体积都约为22.4 L
B.H2的气体摩尔体积约为22.4 L
C.在标准状况下,1 mol H2和1 mol H2O所占的体积都约为22.4 L
D.在标准状况下,22.4 L由N2、N2O组成的混合气体中所含有的N的物质的量约2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的说法中正确的是
A.蒸馏时,温度计的水银球应伸入液面下
B.在持续加热的情况下,向蒸馏烧瓶内补加碎瓷片
C.重结晶时,趁热过滤的目的是减少被提纯物质的损失
D.在萃取实验中,可以用乙醇萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g) + I2(g)![]() 2HI(g) ΔH =-a kJ/mol(a>0),在一定温度下,向一固定容积的密闭容器中通入1molH2(g) 和1molI2(g),达平衡时放出的热量为Q1,在相同条件下,向该容器中通入2molHI(g)达平衡时发现各物质的浓度与前平衡完全相同且吸收的热量为Q2,则下列说法正确的是:
2HI(g) ΔH =-a kJ/mol(a>0),在一定温度下,向一固定容积的密闭容器中通入1molH2(g) 和1molI2(g),达平衡时放出的热量为Q1,在相同条件下,向该容器中通入2molHI(g)达平衡时发现各物质的浓度与前平衡完全相同且吸收的热量为Q2,则下列说法正确的是:
A. H2的燃烧热为a kJ/mol
B. 该反应的能量变化可用如图来表示
C. H2(g) + I2(s)![]() 2HI(g) ΔH <-a kJ/mol
2HI(g) ΔH <-a kJ/mol
D. Q1和Q2的大小关系为Q1 + Q2 = a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸是常用的干燥剂,都能用浓硫酸干燥的一组气体是( )
A. CH4、H2、CO、NH3 B. CO2、H2、SO2、Cl2
C. CO、CH4、HCl、HBr D. SO2、CO2、H2、H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温家宝总理在2010年政府工作报告中提出:“要大力开发低碳技术,推广高效节能技术,积极发展新能源和可再生能源。”下列有关做法与此不相符的是
A.大力开发丰富的煤炭资源,减少对石油的依赖
B.回收废弃饮料包装纸,制作成公园内的休闲长椅
C.在西部和沿海地区兴建风力发电站,解决能源问题
D.鼓励购买小排量汽车,推广与发展电动、混合动力汽车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:
①过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3。
②5Fe2++ MnO4-+8H+=5Fe3+ +Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有_____。
(2)沉淀反应的离子方程式是______________。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入30 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积31.60 mL。
步骤3:向滴定后的溶液中加入3g Zn粉和8 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为______。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如下图,其变化趋势的原因可能为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,ag气体A与bg气体B的分子数相同,下列说法中不正确的是( )
A.同温同压下A,B两气体的密度之比为a:b
B.同质量气体A与B的分子数之比为b:a
C.两种气体A与B的相对分子质量之比为b:a
D.相同状况下同体积A,B质量之比为a:b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com