
【题目】某研究性学习小组在实验室模拟工业“侯氏制碱法”原理制取NaHCO3 . 下图是该学习小组进行模拟实验时所用到的主要装置. 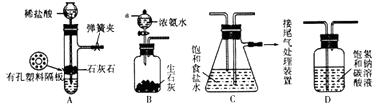
请回答下列问题:
(1)B装置中仪器a的名称是 .
(2)C装置中发生的现象是 , 反应的化学方程式是
(3)检验A装置气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,向漏斗里注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,若 . 说明装置不漏气.
(4)D是连接在装置A与装置C之间的气体净化装置,装置D的作用是 .
(5)实验时向饱和NaCl溶液中先通入NH3 , 再通入CO2的原因是 .
(6)设计实验方案,检验NaHCO3产品中是否含有氯化钠
【答案】
(1)分液漏斗
(2)液面上下波动有白色固体析出;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(3)长漏斗中与试管中的液(水)面差保持不再变化或漏斗中的液(水)面不再下降
(4)除去二氧化碳中的氯化氢
(5)使溶液呈碱性,二氧化碳更易被吸收
(6)取少量产品溶于水,加入足量的稀硝酸,再滴加硝酸银溶液,若有白色沉淀生成,则证明产品中有氯化钠
【解析】解:“侯氏制碱法”原理制取NaHCO3流程:反应的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,装置A:制取二氧化碳,装置B:制取氨气,装置C:用二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,装置D:除去二氧化碳中的氯化氢,所以A接D后接C.(1)B装置中仪器a带有玻璃活塞,控制滴加浓氨水的速率,为分液漏斗,所以答案是:分液漏斗;(2)二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,反应的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,由于碳酸氢钠的溶解度较小,所以会出现白色浑浊,现象为液面上下波动有白色固体析出,
所以答案是:液面上下波动有白色固体析出;NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;(3)随水的注入管内加压增大,漏斗内液体不能再流入试管,使长颈漏斗与管内液面出现液面差,并且液面差保持不变,说明装置气密性良好,所以答案是:长漏斗中与试管中的液(水)面差保持不再变化或漏斗中的液(水)面不再下降;(4)装置A:制取二氧化碳,用碳酸钙和盐酸反应,盐酸易挥发,制取的二氧化碳中混有氯化氢,装置D内盛放的碳酸氢钠溶液能与二氧化碳中的HCl发生反应生成氯化钠、水和二氧化碳,从而除去HCl,二氧化碳气体与碳酸氢钠溶液不反应所以答案是:除去二氧化碳中的氯化氢;(5)二氧化碳与水反应形成不稳定的碳酸,致使水吸收二氧化碳量较少,氨气在水中的溶解度大于二氧化碳,先通入氨气,氨气与水形成呈碱性的氨水可与二氧化碳与水生成的碳酸发生反应,更有利于二氧化碳气体的吸收,所以答案是:使溶液呈碱性,二氧化碳更易被吸收;(6)要检验产品碳酸钠中是否含有氯化钠,实际上就是检验氯离子的存在,可先滴加过量稀硝酸,排除碳酸根离子的干扰,在滴加硝酸银溶液,如果有白色沉淀生成,则含有氯离子,所以答案是:取少量产品溶于水,加入足量的稀硝酸,再滴加硝酸银溶液,若有白色沉淀生成,则证明产品中有氯化钠.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素A,B,C,D,E在元素周期表中的相对位置如图所示,下列说法正确的( ) 
A.原子半径的大小顺序为:rA>rB>rC>rD>rE
B.元素D的最高价氧化物对应的水化物的酸性比E的强
C.A,D两种元素在自然界中都存在相应的单质
D.C的最高价氧化物的水化物与E的最高价氧化物的水化物之间不能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国空气质量预报的内容主要包括三个方面:二氧化硫、氮氧化物(NOx)、悬浮颗粒物等三种大气污染物的浓度.
(1)①与氮氧化物有关的全球或区域性大气环境问题有(填字母序号).
a.酸雨 b.沙尘暴 c.光化学烟雾 d.温室效应
②悬浮颗粒物可用高压电除尘,是利用了现象
(2)为了降低汽车尾气对大气的污染,目前最有效的方法是给汽车安装尾气净化装置.它能将尾气中的一氧化碳和NO在催化剂作用下,发生反应转化为无害气体,其反应的化学方程式为 .
(3)①写出实验室中由固体物质制取氨气的化学方程式;
②欲收集一瓶干燥的氨气,选择图1中的装置,其连接顺序为:发生装置→(按气流方向,用小写字母表示)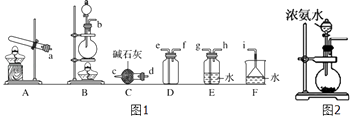
③实验室也可用图2所示装置制取氨气.烧瓶内固体可选用(选填选项的代号).
a.碱石灰 b.生石灰 c.二氧化硅 d.五氧化二磷
④催化剂存在下,NH3也可用来消除NOx的污染,生成两种对环境无害的物质,请写出NH3与NO2反应的化学方程式为 , 该反应中每生成0.5molN2转移 mol电子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1 molH的质量为2g B. 标准状况下,1mol水的体积约为22.4 L
C. OH-的摩尔质量为17g D. 1mol Ne 含有的电子数目为6.02×1024
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )
A.原子序数:X<YB.原子半径:X<YC.离子半径:X>YD.电负性:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色溶液中,下列离子能大量共存的是
A. Na+、NH4+、NO3-、MnO4- B. K+、SO42-、OH-、CO32-
C. K+、Fe3+、Cl-、Br- D. Ba2+、Na+、OH-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质Z是一种常见的半导体材料,可由X通过如图所示的路线制备. ![]()
其中X为Z的氧化物;Y为氢化物,分子结构与甲烷相似.下列说法错误的是( )
A.X可以和氢氟酸反应
B.甲烷的稳定性比Y强
C.Z是将太阳能转换为电能的常用材料
D.上述①②③变化过程中,依次发生置换反应、复分解反应和分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.氯化铯晶体中,每1个Cs+与其他8个Cs+等距离紧邻
B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子
C.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
D.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com