
【题目】SO2及Cl2是实验室常见的两种气体。
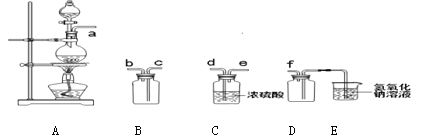
(1)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2 ,按气流方向连接各仪器接口,顺序为a![]()
![]()
![]()
![]()
![]() f,装置D的作用是_____。
f,装置D的作用是_____。
(2)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要________、________(填写试剂或溶液名称)。
(3)将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有 (填微粒符号)。
(4)某小组利用刚吸收过少量SO2的NaOH溶液对Cl2进行尾气处理。
①请完成吸收初期的化学方程式:Cl2+Na2SO3+2 NaOH= 。
②吸收一段时间后,某同学取出2mL吸收后的溶液(强碱性)于试管中,充分振荡后向其中滴加3~4滴淀粉-KI溶液,发现溶液先变蓝,随即又褪去。溶液先变蓝,说明吸收后的溶液中存在 (填微粒符号),用离子方程式表示蓝色褪去的可能原因: 。
【答案】(1)d、e、c、b 防倒吸
(2)饱和食盐水、NaOH溶液
(3)Cl2、HClO、 ClO-
(4)2NaCl+Na2SO4+ H2O
(5)ClO- I2 +2OH-=I- + IO- +2H2O
【解析】
试题分析:(1)A是SO2的制备装置,B是收集装置,C是干燥装置,由于SO2密度大于空气,应该用向上排空气法收集,则连接顺序为a、d、e、c、b、f。又因为SO2有毒,需要尾气处理,且易溶于水,所以D装置的作用是防止倒吸。
(2)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要除去氯化氢的饱和食盐水以及尾气处理的氢氧化钠。
(3)将Cl2通入水中,部分氯气与水反应生成氯化氢和次氯酸,次氯酸电离出氢离子和次氯酸根离子,则所得溶液中具有氧化性的含氯粒子有Cl2、HClO、ClO-。
(4)①氯气具有强氧化性,能把亚硫酸钠氧化为硫酸钠,反应的化学方程式为Cl2+Na2SO3+2 NaOH=2NaCl+Na2SO4+H2O。
②溶液先变蓝,说明有氧化性的微粒把碘化钾氧化为单质碘,则吸收后的溶液中存在ClO-;蓝色褪去是由于生成的碘与氢氧根反应,方程式为I2 +2OH-=I- + IO- +2H2O。


科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B分子数相同,下列说法中不正确的是( )
A.气体A与B的相对分子质量比为m∶n
B.同质量气体A与B的分子个数比为n∶m
C.同温同压下,同体积A气体与B气体的密度比为n∶m
D.相同状况下,同体积A气体与B气体质量比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
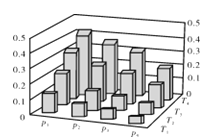
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.若T1> T2> T3>T4,则该反应为放热反应
D.缩小容积,可以提高CH3OH在混合物中的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中水既不是氧化剂又不是还原剂的氧化还原反应是( )
A.SO3+H2O=H2SO4 B.2Na2O2+2H2O=4NaOH+O2↑
C.2F2+2H2O=4HF+O2 D.2Na+2H2O=2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组实验:①含有水分的植物油中除去水分;②回收碘的CCl4溶液中的CCl4;③用食用酒精浸泡中草药提取其中的有效成分。分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
(1)M在元素周期表中的位置是__________________________。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________。
(3)由X、Y、Z三种元素可组成摩尔质量为84g·mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_____________________。
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为________。
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式为____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com