
【题目】设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法不正确的是
A.H2(g)+![]() O2(g)=H2O(l) ΔH=-286 kJ·mol1,则每1 mol [H2(g)+
O2(g)=H2O(l) ΔH=-286 kJ·mol1,则每1 mol [H2(g)+![]() O2(g)]生成1 mol [H2O(l)]放热286 kJ
O2(g)]生成1 mol [H2O(l)]放热286 kJ
B.Cr2O72-+ne+14H+=2Cr3++7H2O,则每生成1 mol Cr3+转移电子数为3NA
C.Al3++4OH=[Al(OH)4],说明1 mol Al(OH)3电离出H+数为NA
D.1 mol CO2与NaOH溶液完全反应,则n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol
【答案】C
【解析】
A项、由热化学方程式可知,氢气在氧气中的燃烧为放热反应,1 mol [H2(g)+![]() O2(g)]生成1 mol [H2O(l)]放热286 kJ,故A正确;
O2(g)]生成1 mol [H2O(l)]放热286 kJ,故A正确;
B项、由铬元素化合价变化可知,生成2 mol Cr3+转移6mol电子,则生成1 mol Cr3+转移电子数为3NA,故B正确;
C项、氢氧化铝是两性氢氧化物,在溶液中发生酸式电离部分电离出氢离子,则1 mol Al(OH)3电离出H+数小于NA,故C错误;
D项、由碳原子个数守恒可知,1 mol CO2与NaOH溶液完全反应生成的盐溶液中,n(CO32-)+n(HCO3-)+n(H2CO3)=1 mol,故D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】我国女科学家屠呦呦发现青蒿素(青蒿素的化学式:C15H22O5),它是一种用于治疗疟疾的药物,曾经挽救了数百万人的生命,近日获得诺贝尔生理与医学奖,成为我国获得诺贝尔科学奖的第一人。下列关于青蒿素的叙述错误的是( )
A. 青蒿素的一个分子中含有42个原子
B. 青蒿素中碳元素的质量分数约为63.8%
C. 青蒿素的相对分子质量为282
D. 0.1 mol青蒿素的质量为28.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.2mol/LKMnO4酸性溶液0.1L与一定量pH=3的草酸(HOOC—COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是
A.该反应释放CO2分子数目为![]() NA
NA
B.pH=3的草酸溶液含有H+数目为0.001NA
C.0.1molHOOC—COOH含共用电子对数目为0.9NA
D.当1molKMnO4被还原时,转移电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是氧化镁和氯化镁的熔、沸点数据:
物质 | 氧化镁 | 氯化镁 |
熔点/℃ | 2852 | 714 |
沸点/℃ | 3600 | 1412 |
请参考以上数据分析,从海水中提取镁,正确的方法是( )
A.海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B.海水![]() MgCl2溶液→MgCl2晶体
MgCl2溶液→MgCl2晶体![]() Mg
Mg
C.海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D.海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl2(熔融)
MgCl2(熔融)![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国城市为了减少燃煤造成的大气污染,对民用燃料煤进行了多方面的改进。
(1)为了除去煤中的含硫化合物,可采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生如下反应:FeS2+14FeCl3+8H2O=2FeSO4+13FeCl2+16HCl。为了充分利用Fe2+并减少HCl污染,可利用工业废铁屑和氯气与废液重新作用生成FeCl3的方法。请写出这一过程中有关的离子方程式:___________________________________。
(2)另一种方法是采用固硫法,即在燃煤中加入生石灰,使含硫煤在燃烧时生成的SO2不能逸出而进入炉渣中,试用化学方程式表示这一“固硫”过程:_______________________________。
(3)某城市采用了以油制气代替煤作民用燃料的做法。油制气的主要成分是丙烷,写出其燃烧的化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.1L0.1molL-1H2C2O4溶液中含C2O![]() 离子数为0.1NA
离子数为0.1NA
B.2molNO与2molO2在密闭容器中充分反应,转移的电子数为8NA
C.32gS8与S6(![]() )的混合物中所含共价键数目为NA
)的混合物中所含共价键数目为NA
D.标准状况下22.4L氯气与甲烷的混合气体,光照时充分反应生成HCl分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较给出![]() 能力的相对强弱:
能力的相对强弱:![]() ________
________![]() (填“>”“<”或“=”);用一个化学方程式说明
(填“>”“<”或“=”);用一个化学方程式说明![]() 和
和![]() 结合
结合![]() 能力的相对强弱________。
能力的相对强弱________。
(2)![]() 是离子化合物,各原子均满足8电子稳定结构。写出
是离子化合物,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以芳香族化合物A为起始原料,按下列路线合成高血压药物阿替洛尔。
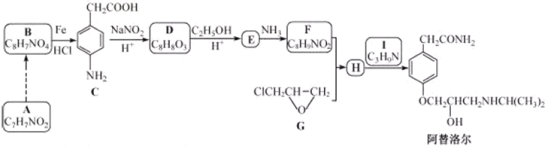
已知:化合物H中除了苯环还有其它环
 :
:![]()
请回答:
(1)下列说法正确的是________。
A.化合物D能发生加成,取代,氧化反应,不发生还原反应
B.化合物E能与![]() 溶液发生显色反应
溶液发生显色反应
C.化合物1具有弱碱性
D.阿替洛尔的分子式是![]()
(2)写出化合物E的结构简式________。
(3)写出![]() 的化学方程式________。
的化学方程式________。
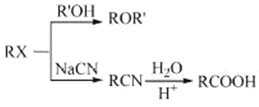
(4)设计从A到B的合成路线(用流程图表示,无机试剂任选)________。
(5)写出化合物C同时符合下列条件的同分异构体的结构简式________。
①![]() 谱和IR谱检测表明:分子中共有4种氢原子,无氮氧键和碳氮双键;
谱和IR谱检测表明:分子中共有4种氢原子,无氮氧键和碳氮双键;
②除了苯环外无其他环。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.苯的同系物是分子中仅含有一个苯环的所有烃类物质
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com