
【题目】常温下,将NaOH溶液滴加到某一元酸(HA)宿液中,测得混合溶液的pH与离子浓度变化关系如下图所示[已知:p =-lg
=-lg ]。下列叙述不正确的是
]。下列叙述不正确的是

A. Ka(HA)的数量级为10-5
B. 滴加NaOH溶液过程中,  保持不变
保持不变
C. m点所示溶液中:c(H+)=c(HA)+c(OH-)-c(Na+)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
【答案】D
【解析】A. HA![]() H+ + A_,Ka(HA)=
H+ + A_,Ka(HA)= 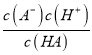 ,p
,p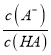 =-lg
=-lg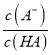 =0时,Ka(HA)=c(H+)=10-4.76,Ka(HA)的数量级为10-5,A正确;B.
=0时,Ka(HA)=c(H+)=10-4.76,Ka(HA)的数量级为10-5,A正确;B. 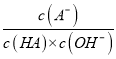 =
=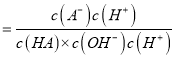 ==ka/kw,而此常数是温度函数,滴加NaOH溶液过程中,
==ka/kw,而此常数是温度函数,滴加NaOH溶液过程中, 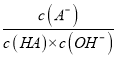 保持不变,B正确;C. 由电荷守恒可知,m点所示溶液中:c(H+)+ c(Na+)=c(A-)+c(OH-),由A分析可知,m点时c(A-)= c(HA),则c(H+)=c(HA)+c(OH-)-c(Na+),故C正确;D. n点时溶液pH=2,HA的物质的量大于NaOH的物质的量,则此时示溶液中:c(Na+)<c(A-)+c(HA)故D错误。答案选D。
保持不变,B正确;C. 由电荷守恒可知,m点所示溶液中:c(H+)+ c(Na+)=c(A-)+c(OH-),由A分析可知,m点时c(A-)= c(HA),则c(H+)=c(HA)+c(OH-)-c(Na+),故C正确;D. n点时溶液pH=2,HA的物质的量大于NaOH的物质的量,则此时示溶液中:c(Na+)<c(A-)+c(HA)故D错误。答案选D。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、M均为中学化学中的常见物质,A~D含有相同元素。其转化关系如下:
![]()
请回答:
(1)若A为淡黄色固体单质。
①A元素在周期表中的位置是_____。
②下列叙述正确的是_____(填字母序号)。
a.B属于大气污染物,是导致酸雨的重要原因之一
b.C可以与CaO反应生成CaSO3
c.D的浓溶液可以在加热条件下与金属Cu反应生成B
(2)若A为能使湿润红色石蕊试纸变蓝的气体。
①写出C→D的化学方程式:_____________________。
②A与C反应生成一种空气中含量最多的气体E,若该反应中转移6mol电子,则生成的E在标准状况下的体积为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.得到的废液中含有Fe2+、Cu2+、Fe3+和Cl﹣.为回收铜并得到纯净的FeCl3溶液,下面是综合利用的主要流程:
(1)FeCl3溶液和铜反应的离子方程式为__。
(2)上述方框内物质A和X的化学式:A__,X__。上述流程中有关Fe2+和Fe3+相互转化的离子方程式是__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用石墨电极电解MgCl2溶液:Mg2++2C1-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B. 向明矾溶液中滴加碳酸钠溶液:2Al3++3CO32-==Al2(CO3)3↓
C. 向Ca(HCO3)2溶液中滴加少最NaOH溶液:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
D. 向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-==3I2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)的关系如下表所示:
初始 | 2 min | 4 min | 6 min | |
c(A)/mol·L-1 | 1.45 | 1.28 | 1.00 | 1.00 |
c(B)/mol·L-1 | 0.38 | 0.72 | 1.28 | 1.28 |
c(C)/mol·L-1 | 0.095 | 0.18 | 0.32 | 0.32 |
(1) 该反应的化学方程式为 __________________________________
(2)4 min末A的转化率约为______________
II.某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
实验编号 | 锌的形态 | 反应温度/℃ | 收集100 mL氢气所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
(3)该实验的目的是探究________、________对锌和稀盐酸反应速率的影响。
(4)实验Ⅰ和Ⅱ表明________,化学反应速率越大。
(5)能表明固体的表面积对反应速率有影响的实验编号是________和________。
(6)请设计一个实验方案证明盐酸的浓度对该反应的速率的影响:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H前者小于后者的是( )
①C(s)+ ![]() O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2
O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2
②S(g)+O2(g)═SO2(g);△H3 S(s)+O2(g)═SO2(g);△H4
③CaO(s)+H2O(l)═Ca(OH)2(s);△H5 CaCO3(s)═CaO(s)+CO2(g);△H6 .
A.②
B.①②
C.①③
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是 ( )
A. 1mol硫酸中含有4mol氧原子 B. 硫酸的摩尔质量是98g
C. 6.02×1023个硫酸分子的质量是98g D. 0.5mol硫酸中含有1g氢元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 | 3.0×10﹣8 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为 .
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是(填字母序号,下同).
A.c(H+) B. ![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D. ![]() E.
E. ![]()
若该溶液升高温度,上述5种表达式的数据增大的是 .
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图: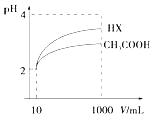
则HX的电离平衡常数(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是 .
(4)已知100℃时,水的离子积为1×10﹣12 , 该温度下测得某溶液pH=7,该溶液显(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com