
����Ŀ���й�������ŵ��2020�굥λGDP������̼�ŷű�2005���½�40%��45%��CO2��ת�����л���ʵ��̼ѭ���������Ϊ1L���ܱ������г���1mol CO2��3mol H2��һ�������·�����Ӧ��![]() �����CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��
�����CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��
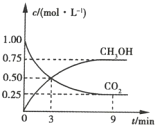
��1��3��9min�ڣ�v(H2)=_________mol��L-1��min-1��
��2����˵��������Ӧ�ﵽƽ��״̬����________������ţ���
A.��Ӧ��CO2��CH3OH�����ʵ���Ũ��֮��Ϊl:1����ͼ�н��㣩
B.���������ܶȲ���ʱ��ı仯���仯
C.��λʱ��������3mol H2��ͬʱ����1mol CO2
D. CO2����������ڻ�������б��ֲ���
��3��ƽ��ʱCO2��ת����Ϊ________
��4��ƽ��ʱ���������CH3OH(g)���������Ϊ________��
���𰸡�0.125 D 75% 30%
��������
��Ӧ![]() Ϊ�����������С�Ŀ��淴Ӧ����Ӧ��ʼ��ƽ�������ƶ�����9minʱ��CO2��CH3OH(g)��Ũ�Ȳ��ٸı䣬˵����Ӧ�ﵽƽ��״̬��
Ϊ�����������С�Ŀ��淴Ӧ����Ӧ��ʼ��ƽ�������ƶ�����9minʱ��CO2��CH3OH(g)��Ũ�Ȳ��ٸı䣬˵����Ӧ�ﵽƽ��״̬��
��1���ɻ�ѧ����ʽ��֪��v(H2)=3v(CO2)=3��(0.50 mol��L-1-0.25 mol��L-1)��6 min=0.125 mol��L-1��min-1��
��2��A���ͼ���֪�����㴦��ʾCO2��CH3OH��Ũ����ȣ�����Ӧδ�ﵽƽ��״̬��B������ݻ����䣬�÷�Ӧ�Ǵ����巴Ӧ�������������ʼ�ղ��䣬���ܶ�ʼ���dz�����C�����H2������H2O����ʾ����Ӧ��������֮��ʼ��Ϊ3:1��D���Ӧ��ϵ��ij������ĺ������䣬˵����Ӧ�ﵽ��ƽ��״̬��
��3��ƽ��ʱCO2��ת����Ϊ![]() ��
��
��4����Ӧǰ�����ʵ����ʵ������£�
| ||||
��ʼ/mol�� | 1 | 3 | 0 | 0 |
ƽ��/mol�� | 0.25 | 3-3��(1-0.25) | 1-0.25 | 1-0.25 |
��ƽ��ʱ���������CH3OH(g)�����������![]() ��
��


 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д� �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�̶��ݻ�Ϊ2L���ܱ������ڼ���0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��N2(g)��3H2(g)2NH3(g)��H��0
(1)ƽ�ⳣ���ı���ʽK=__________���÷�Ӧ450����ƽ�ⳣ��__________500��ʱ��ƽ�ⳣ��(����>������<������=��)��
(2)������������˵��������Ӧ�Ѵ�ƽ�����__________
A��3����(H2)��2����(NH3)
B�������������ƽ����Է���������ʱ����仯
C��������������ܶȲ���ʱ����仯
D������������ķ�����������ʱ����仯
(3)������Ӧ����5����ʱ�ﵽƽ�⣬���NH3�����ʵ���Ϊ0.2mol����ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ������(N2)Ϊ__________mol/(L��min)��NH3���������__________
(4)���������������䣬����ʼͶ����ΪamolN2��bmolH2��cmolNH3��Ҳ�ɵõ���������ͬ��ƽ�⣬��a��b��c�������ϵʽ��__________��
(5)��6����ʱ�����������������䣬������ͨ��0.2mol��N2��0.6mol��H2��8����ʱ�ﵽƽ�⣬N2��ת����__________(����������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaHSO4��NaHCO3��������Ҫ����ʽ�Ρ�
(1)NaHSO4��������ˮ�����ԣ���NaHCO3��������ˮ�Լ��ԣ��������ӷ���ʽ�����Ա�Ҫ��������˵��NaHCO3��������ˮ�Լ��Ե�ԭ��___��
(2)�����°�1mL0.2mol��L-1��NaHSO4��Һ��ˮϡ�ͳ�2L��Һ����ʱ��Һ����ˮ���������c(H+)Ϊ___��
(3)NaHSO4��NaHCO3����Һ��Ϸ�Ӧ�����ӷ���ʽΪ___��
(4)��NaHSO4��Һ����μ���Ba(OH)2��Һ�����ԣ���д����Ӧ�����ӷ���ʽ��___����������Һ�У������μ�Ba(OH)2��Һ����ʱ��Ӧ�����ӷ���ʽΪ___��
(5)����������������ʵ���Ũ�ȵ�NaHCO3��Һ��Ba(OH)2��Һ��ϣ���Ӧ�����ӷ���ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС������ͼ��ʾװ��̽������п��ϡ����ķ�Ӧ��ʵ������е�������ָ�뷢��ƫת����ش��������⣺
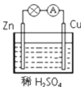
(1)пƬ����ص�__________������������������ĵ缫��Ӧʽ��__________��
(2)ͭƬ��������__________�������ĵ缫��Ӧʽ��__________��
(3)����ϡH2SO4����CuSO4����������ӦʽΪ��__________��
(4)�����缫������Ƭ��ͭƬ������__________�����Ƭ��ͭƬ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L�ܱ�������X��Y��Z������̬���ʵ����ʵ���(n)��ʱ��(t)�仯��������ͼ��ʾ����ͼ������
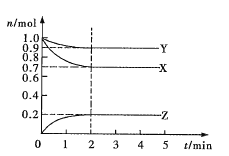
(1)�÷�Ӧ�Ļ�ѧ����ʽΪ______________��
(2)��Ӧ��ʼ��2min����Z��ʾ��ƽ����Ӧ����Ϊ_________��
(3)����������˵��������Ӧ�ﵽ��ѧƽ��״̬����________(�����)
A.�������������ʵ�������ʱ��ı仯���仯
B.��������ѹǿ����ʱ��ı仯���仯
C.��λʱ����ÿ����![]() X��ͬʱ����
X��ͬʱ����![]() Z
Z
D.������������������ʱ��ı仯���仯
E.���������ܶȲ��ٷ����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ý�屨��������һ�ҹ�˾Tiamat��ǰ�з����ȵ�ǰ�㷺ʹ�õ�﮵�سɱ����͡���������������ٶȸ���������ӵ�أ�Ԥ�ƴ�2020�꿪ʼʵ�ֹ�ҵ�������õ�صĸ�������Ϊ![]() �Ʊ�ԭ��Ϊ
�Ʊ�ԭ��Ϊ![]() ��
��![]() ��
��![]() �����ҺΪ
�����ҺΪ![]() ��̼���ϩ����Һ��
��̼���ϩ����Һ��
�ش��������⣺
(1)Te����Ԫ�����ڱ���______��Ԫ�أ����̬ԭ�ӵļ۵����Ų�ʽΪ______��
(2)��̬Naԭ���У��������ռ�ݵ�ԭ�ӹ������Ϊ______��
(3)���������Ϣ�жϣ�C��O��Cl�ĵ縺���ɴ�С��˳��Ϊ______![]() ��Ԫ�ط��ű�ʾ
��Ԫ�ط��ű�ʾ![]() ��
��
(4)̼���ϩ���Ľṹ��ʽ����ͼ��ʾ��������̼ԭ�ӵ��ӻ��������Ϊ______��1mol̼���ϩ������������ĿΪ______��
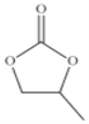
![]() �ļ��ι���Ϊ���������Σ�������______���������Ӱ�����������Ϊ______
�ļ��ι���Ϊ���������Σ�������______���������Ӱ�����������Ϊ______![]() ��ѡ����ĸ
��ѡ����ĸ![]() ��
��
A.���Ӽ� B.���Լ� C.��λ�� D.��� E.������
(6)Na��O�γɵ����ӻ�����ľ����ṹ����ͼ��ʾ���þ������ܶ�Ϊ��g/![]() �������ӵ�������ֵΪ
�������ӵ�������ֵΪ![]() ����Na��O֮�����̾���Ϊ_______________________
����Na��O֮�����̾���Ϊ_______________________ ![]() �ú�����
�ú�����![]() �Ĵ���ʽ��ʾ
�Ĵ���ʽ��ʾ![]() ��
��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڳ����µ������Һ�������У���ȷ����( )
A.��![]()
![]() ��Һ�м�������
��Һ�м�������![]() NaOH��Һ�������Һ��
NaOH��Һ�������Һ��![]() ����ˮ�ĵ���̶ȱȴ�ˮ�Ĵ�
����ˮ�ĵ���̶ȱȴ�ˮ�Ĵ�
B.![]() ʱ��
ʱ��![]() ��
��![]() ��Һ����ˮ�������
��Һ����ˮ�������![]()
C.�����ʵ���Ũ�ȵ�![]() ��Һ��
��Һ��![]() ��Һ�У�
��Һ�У�![]() ǰ��С�ں���
ǰ��С�ں���
D.�����ʵ���Ũ�ȡ�������İ�ˮ�������Ϻ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���� ( ����)
A.�����(![]() )������̼ԭ�Ӳ�ȫ��ͬһƽ����
)������̼ԭ�Ӳ�ȫ��ͬһƽ����
B.��ϩ���Ҵ�����ʹ����KMnO4��Һ��ɫ
C.![]() ��
��![]() ��Ϊͬ���칹�壬�Ҷ��ȴ����Ϊ6��
��Ϊͬ���칹�壬�Ҷ��ȴ����Ϊ6��
D.���������������������Ӧ����ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��2����������������Ϳ����������Ӽ���������������ɫҺ�壬�ܶ���2.18g/cm3���е�131.4�����۵�9.79����������ˮ�������ڴ����ѡ���ͪ���л��ܼ�����ʵ���п�������ͼ��ʾװ���Ʊ�1��2���������������з�Һ©������ƿa��װ���Ҵ���Ũ����Ļ��Һ���Թ�d��װ��Ũ��ˮ�����渲������ˮ����
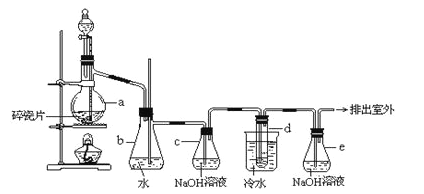
����д���пհף�
��1����ƿa�з��������Ҵ�����ˮ��Ӧ������ȥ��Ӧ����Ӧ�¶���170�������Ҹ÷�ӦҪ���¶�Ѹ�����ߵ�170������������������Ӧ����д���Ҵ�������ȥ��Ӧ�ķ���ʽ ��
��2��д���Ʊ�1��2����������Ļ�ѧ����ʽ�� ��
��3����ȫƿb���Է�ֹ�����������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������ش�������ʱƿb�е����� ��
��4������c��NaOH��Һ�������ǣ� ��
��5���жϸ��Ʊ���Ӧ�Ѿ��������������___________________________��
��6�������������������������ѣ�����__________�ķ�����ȥ��
��7����Ӧ������Ӧ����ˮ��ȴװ��d������ҪĿ����___________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com