
【题目】NaHSO4与NaHCO3是两种重要的酸式盐。
(1)NaHSO4固体溶于水显酸性,而NaHCO3固体溶于水显碱性,请用离子方程式并配以必要的文字来说明NaHCO3固体溶于水显碱性的原因___。
(2)常温下把1mL0.2mol·L-1的NaHSO4溶液加水稀释成2L溶液,此时溶液中由水电离产生的c(H+)为___。
(3)NaHSO4和NaHCO3两溶液混合反应的离子方程式为___。
(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出反应的离子方程式:___;在以上溶液中,继续滴加Ba(OH)2溶液,此时反应的离子方程式为___。
(5)若将等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,反应的离子方程式为___。
【答案】NaHCO3=Na++![]() ,
,![]() +H2O
+H2O![]() H2CO3+OH-,
H2CO3+OH-,![]()
![]()
![]() +H+,且
+H+,且![]() 水解程度大于电离程度,故溶液呈碱性 1×10-10mol·L-1 H++
水解程度大于电离程度,故溶液呈碱性 1×10-10mol·L-1 H++![]() =H2O+CO2↑ 2H++
=H2O+CO2↑ 2H++![]() +Ba2++2OH-=BaSO4↓+2H2O
+Ba2++2OH-=BaSO4↓+2H2O ![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓ ![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
【解析】
NaHSO4固体溶于水只发生电离,而NaHCO3固体溶于水后电离产生的![]() 既能电离又能水解,但以水解为主;NaHSO4溶液加水稀释,所得溶液中由水电离产生的c(H+)等于溶液中的c(OH-);NaHSO4和NaHCO3两溶液混合,NaHSO4表现酸的性质与NaHCO3反应,生成二氧化碳气体。NaHSO4、NaHCO3溶液中逐滴加入Ba(OH)2溶液,采用“以少定多”法确定反应的产物以及发生的反应。
既能电离又能水解,但以水解为主;NaHSO4溶液加水稀释,所得溶液中由水电离产生的c(H+)等于溶液中的c(OH-);NaHSO4和NaHCO3两溶液混合,NaHSO4表现酸的性质与NaHCO3反应,生成二氧化碳气体。NaHSO4、NaHCO3溶液中逐滴加入Ba(OH)2溶液,采用“以少定多”法确定反应的产物以及发生的反应。
(1) NaHCO3固体溶于水后电离产生的![]() ,在溶液中主要发生水解,从而使溶液显碱性,其原因为:NaHCO3=Na++
,在溶液中主要发生水解,从而使溶液显碱性,其原因为:NaHCO3=Na++![]() ,
,![]() +H2O
+H2O![]() H2CO3+OH-,
H2CO3+OH-,![]()
![]()
![]() +H+,且
+H+,且![]() 水解程度大于电离程度,故溶液呈碱性。答案为:NaHCO3=Na++
水解程度大于电离程度,故溶液呈碱性。答案为:NaHCO3=Na++![]() ,
,![]() +H2O
+H2O![]() H2CO3+OH-,
H2CO3+OH-,![]()
![]()
![]() +H+,且
+H+,且![]() 水解程度大于电离程度,故溶液呈碱性;
水解程度大于电离程度,故溶液呈碱性;
(2)常温下把1mL0.2mol·L-1的NaHSO4溶液加水稀释成2L溶液,此时溶液中c(H+)=![]() =10-4mol/L,由水电离产生的c(H+)= c(OH-)溶液=
=10-4mol/L,由水电离产生的c(H+)= c(OH-)溶液=![]() mol/L=1×10-10mol·L-1。答案为:1×10-10mol·L-1;
mol/L=1×10-10mol·L-1。答案为:1×10-10mol·L-1;
(3)NaHSO4和NaHCO3两溶液混合,反应生成Na2SO4、H2O、CO2,反应的离子方程式为H++![]() =H2O+CO2↑。答案为:H++
=H2O+CO2↑。答案为:H++![]() =H2O+CO2↑;
=H2O+CO2↑;
(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,可设NaHSO4为1mol,则H+为1mol、![]() 为1mol,需OH-1mol,则加入Ba(OH)2为0.5mol,反应的离子方程式:2H++
为1mol,需OH-1mol,则加入Ba(OH)2为0.5mol,反应的离子方程式:2H++![]() +Ba2++2OH-=BaSO4↓+2H2O;由于
+Ba2++2OH-=BaSO4↓+2H2O;由于![]() 有剩余,在以上溶液中,继续滴加Ba(OH)2溶液,又产生BaSO4沉淀,此时反应的离子方程式为
有剩余,在以上溶液中,继续滴加Ba(OH)2溶液,又产生BaSO4沉淀,此时反应的离子方程式为![]() +Ba2+=BaSO4↓。答案为:2H++
+Ba2+=BaSO4↓。答案为:2H++![]() +Ba2++2OH-=BaSO4↓+2H2O;
+Ba2++2OH-=BaSO4↓+2H2O;![]() +Ba2+=BaSO4↓;
+Ba2+=BaSO4↓;
(5)若将等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,则生成BaCO3、NaOH、H2O,反应的离子方程式为![]() +Ba2++OH-=BaCO3↓+H2O。答案为:
+Ba2++OH-=BaCO3↓+H2O。答案为:![]() +Ba2++OH-=BaCO3↓+H2O。
+Ba2++OH-=BaCO3↓+H2O。


科目:高中化学 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物![]() 含
含![]() 、
、![]() ,过滤后得到的滤液用
,过滤后得到的滤液用![]() 溶液处理,测得溶液的pH和
溶液处理,测得溶液的pH和![]() 生成的量随加入
生成的量随加入![]() 溶液体积变化的曲线如下图所示。下列有关说法错误的是( )
溶液体积变化的曲线如下图所示。下列有关说法错误的是( )
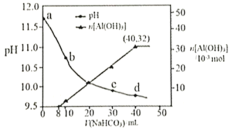
A.a点溶液中存在:![]()
B.水的电离程度:a点小于c点
C.原![]() 溶液中
溶液中![]()
D.生成沉淀的离子方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容器内进行某一反应,M、N的物质的量随反应时间变化的曲线如下图所示,则下列叙述中,正确的是( )

A. 反应的化学方程式一定为2M![]() N
N
B. ![]() 时,逆反应速率一定大于正反应速率
时,逆反应速率一定大于正反应速率
C. ![]() 时,反应达到了化学平衡状态
时,反应达到了化学平衡状态
D. ![]() 时,正反应速率等于逆反应速率
时,正反应速率等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,反应:A(s)+2B(g)![]() C(g) +D(g)。下列不能表明反应
C(g) +D(g)。下列不能表明反应
达到平衡状态的是( )。
A.气体的压强不变B.气体平均相对分子质量不变
C.气体的密度不变D.B物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)cH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示

步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)M在元素周期表中的位置为________________。
(2)X与Y按原子个数比2∶1构成的物质的电子式为________________;所含化学键类型_________。
(3)X+、 Y2-、M2-离子半径大小顺序为_____________________________________。
(4)将YM2通入FeCl3溶液中的离子方程式:______________________________________。
Ⅱ.如下图转化关系:![]()
![]()
![]()
![]()
![]()
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为_______________________。
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应![]() 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
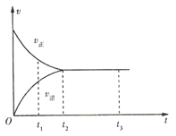
A.t1时,反应只向正方向进行B.t2时,反应未达到限度
C.t2~t3,反应已停止D.t2~t3,各物质的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺到2020年单位GDP二氧化碳排放比2005年下降40%~45%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:![]() ,测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
,测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
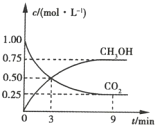
(1)3~9min内,v(H2)=_________mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是________(填序号)。
A.反应中CO2与CH3OH的物质的量浓度之比为l:1(即图中交点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol CO2
D. CO2的体积分数在混合气体中保持不变
(3)平衡时CO2的转化率为________
(4)平衡时混合气体中CH3OH(g)的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国用BeO、KBF4等原料制备KBe2BO3F2晶体,在世界上首次实现在177.3 nm深紫外激光倍频输出,其晶胞如图所示。下列说法错误的是( )
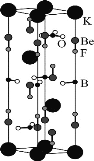
A. 构成晶体的非金属元素的电负性由大到小的顺序为F>O>B
B. KBF4中的阴离子的中心原子的杂化方式为sp2
C. 根据元素周期表中元素所处的位置可推测BeO与Al2O3性质相似
D. 晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则1mo1该晶胞含3molKBe2BO3F2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com