
【题目】生产上用过量烧碱溶液处理某矿物![]() 含
含![]() 、
、![]() ,过滤后得到的滤液用
,过滤后得到的滤液用![]() 溶液处理,测得溶液的pH和
溶液处理,测得溶液的pH和![]() 生成的量随加入
生成的量随加入![]() 溶液体积变化的曲线如下图所示。下列有关说法错误的是( )
溶液体积变化的曲线如下图所示。下列有关说法错误的是( )
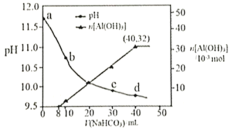
A.a点溶液中存在:![]()
B.水的电离程度:a点小于c点
C.原![]() 溶液中
溶液中![]()
D.生成沉淀的离子方程式为![]()
【答案】C
【解析】
根据题意可知a点为偏铝酸钠和氢氧化钠混合溶液,![]() 碳酸氢钠与过量的氢氧化钠反应,
碳酸氢钠与过量的氢氧化钠反应,![]() 碳酸氢钠与偏铝酸钠反应,据此分析选项是否正确。
碳酸氢钠与偏铝酸钠反应,据此分析选项是否正确。
A.a点为偏铝酸钠和氢氧化钠混合溶液,根据电荷守恒分析判断;
B.水的电离程度:a点为偏铝酸钠和氢氧化钠的混合液,c点为偏铝酸钠与碳酸钠的混合液,因为酸碱抑制水的电离,盐类水解促进水的电离;
C.加入![]() 溶液时沉淀最多,沉淀为
溶液时沉淀最多,沉淀为![]() ,前
,前![]() 溶液和氢氧化钠反应
溶液和氢氧化钠反应![]() 不生成沉淀,后
不生成沉淀,后![]() 溶液与偏铝酸钠反应
溶液与偏铝酸钠反应![]() 生成沉淀,则原
生成沉淀,则原![]() 溶液物质的量浓度
溶液物质的量浓度![]() ,原
,原![]() 溶液中的物料守恒判断;
溶液中的物料守恒判断;
D.强酸制弱酸原理写出离子方程式。
![]() 点为偏铝酸钠和氢氧化钠混合溶液,根据电荷守恒可以写出:
点为偏铝酸钠和氢氧化钠混合溶液,根据电荷守恒可以写出:![]() ,故A正确;
,故A正确;
B.水的电离程度:a点为偏铝酸钠和氢氧化钠的混合液,c点为偏铝酸钠与碳酸钠的混合液,因为酸碱抑制水的电离,盐类水解促进水的电离,所以水的电离程度:a点小于c点,故B正确;
C.加入![]() 溶液时沉淀最多,沉淀为
溶液时沉淀最多,沉淀为![]() ,前
,前![]() 溶液和氢氧化钠反应(
溶液和氢氧化钠反应(![]() )不生成沉淀,后
)不生成沉淀,后![]() 溶液与偏铝酸钠反应生成沉淀
溶液与偏铝酸钠反应生成沉淀![]() ,则原
,则原![]() 溶液物质的量浓度
溶液物质的量浓度![]() ,原
,原![]() 溶液中的物料守恒为
溶液中的物料守恒为![]() ,故C错误;
,故C错误;
D.根据强酸制弱酸原理可以写出离子方程式![]() ,故D正确;
,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】用0.100molL-1AgNO3滴定500mL0.0500molL-1Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )
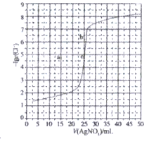
A.曲线上各点的溶液满足关系式c(Ag+)c(Cl-)= Ksp(AgCl)
B.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
C.相同实验条件下,若改为0.0500molL-1Br-,反应终点c向b方向移动
D.相同实验条件下,若改为0.0400molL-1Cl-,反应终点c移到a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SBP电解法能大幅度提高电解槽的生产能力,如图为SBP电解法制备MoO3的示意图,下列说法错误的是( )
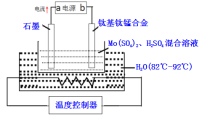
A.a极为电源的负极,发生氧化反应
B.电路中转移4mol电子,则石墨电极上产生标准状况下22.4LO2
C.钛基钛锰合金电极发生的电极反应为:3H2O+Mo4+-2e-=MoO3+6H+
D.电路中电子流向为:a极![]() 石墨,钛基钛锰电极
石墨,钛基钛锰电极![]() b极
b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 L某混合溶液中,溶质X、Y浓度都为0.1mol·L—1,向混合溶液中滴加0.1 mol·L—1某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是 ( )
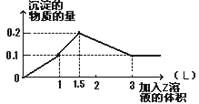
A.偏铝酸钠、氢氧化钡、硫酸
B.氯化铝、氯化镁、氢氧化钠
C.氯化铝、氯化铁、氢氧化钠
D.偏铝酸钠、氯化钡、硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容积相同的两个密闭容器中,一个充入2 mol SO2、1 mol O2,另一个充入2 mol SO3,发生反应2SO2(g)+O2(g) ![]() 2SO3(g);ΔH=-196.6 kJ/mol分别达到平衡时,下列六种说法中正确的有( )
2SO3(g);ΔH=-196.6 kJ/mol分别达到平衡时,下列六种说法中正确的有( )
①二氧化硫的转化率与三氧化硫的分解率之和为1
②达到平衡所需的时间相等 ③密度相等 ④压强相等
⑤放出与吸收的热量相等 ⑥二氧化硫的浓度相同
A. 3种 B. 4种
C. 5种 D. 6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)
(1)该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为_________。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①____________________________________________________;
②_____________________________________________________。
(3)某些金属氧化物粉末和铝粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是___________________。
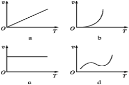
(4)写出氢氧化铝在水中发生碱式电离的电离方程式:___________________欲使上述体系中铝离子浓度增加,可加入的物质是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)△H<0
(1)平衡常数的表达式K=__________,该反应450℃的平衡常数__________500℃时的平衡常数(填“>”、“<”或“=”);
(2)下列描述中能说明上述反应已达平衡的是__________
A.3υ正(H2)=2υ逆(NH3)
B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol计算从反应开始到平衡时,平均反应速率υ(N2)为__________mol/(L·min),NH3的体积分数__________
(4)保持其他条件不变,若初始投入量为amolN2、bmolH2、cmolNH3,也可得到与上述相同的平衡,则a、b、c需满足关系式:__________;
(5)第6分钟时,保持其它条件不变,若继续通入0.2mol的N2和0.6mol的H2,8分钟时达到平衡,N2的转化率__________(填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO4与NaHCO3是两种重要的酸式盐。
(1)NaHSO4固体溶于水显酸性,而NaHCO3固体溶于水显碱性,请用离子方程式并配以必要的文字来说明NaHCO3固体溶于水显碱性的原因___。
(2)常温下把1mL0.2mol·L-1的NaHSO4溶液加水稀释成2L溶液,此时溶液中由水电离产生的c(H+)为___。
(3)NaHSO4和NaHCO3两溶液混合反应的离子方程式为___。
(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出反应的离子方程式:___;在以上溶液中,继续滴加Ba(OH)2溶液,此时反应的离子方程式为___。
(5)若将等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,反应的离子方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com