
【题目】SBP电解法能大幅度提高电解槽的生产能力,如图为SBP电解法制备MoO3的示意图,下列说法错误的是( )
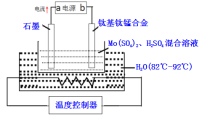
A.a极为电源的负极,发生氧化反应
B.电路中转移4mol电子,则石墨电极上产生标准状况下22.4LO2
C.钛基钛锰合金电极发生的电极反应为:3H2O+Mo4+-2e-=MoO3+6H+
D.电路中电子流向为:a极![]() 石墨,钛基钛锰电极
石墨,钛基钛锰电极![]() b极
b极
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有机物A有以下一系列反应,可以转化为F,
![]()
已知E的分子式为C2H6O2,B的分子结构分析,核磁共振氢谱图中有两个峰,而且峰的面积之比为3:2。回答下列问题:
(1)A→B的反应类型是____反应,E的官能团名称是____
(2)A的结构简式为______,D的系统命名为_______
(3)写出化学方程式
①D→E___________
②B→C __________
II.某有机物的蒸气密度是相同状态下甲烷密度的5.75倍,把1.84g该有机物在氧气中充分燃烧,将生成的气体混合物通过足量碱石灰,碱石灰增重4.08g,又知生成水和二氧化碳的物质的量之比为4:3,试求此有机物的分子式为_____,已知该有机物中只含一种官能团,且两个该官能团连在同一碳上的物质不稳定,则该有机物的结构简式为___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
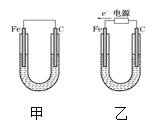
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的___棒,乙装置中的____棒;
②乙装置的电化学防护法称为____,其中碳极的电极反应式是:_____。
③取少量甲装置中负极附近溶液加入2滴K3[Fe(CN)6]溶液,现象为___,发生反应的离子方程式为________
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:______。
②甲装置碳极的电极反应属于_____(填“氧化反应”或“还原反应”);
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因_____
(3)用铂作电极电解饱和的下列物质的水溶液,一会儿后,向剩余电解液中加适量水,能使溶液和电解前相同的是(_____)
A.KI B.H2SO4 C.CuCl2 D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与CH2=CH2 → CH2Br—CH2Br的变化属于同一反应类型的是 ( )
A. CH2=CH2 →C2H5OHB. CH3 CH=CH2→CH2 Cl CH=CH2
C. ![]() D. CH3CH2Br→ CH3CH2OH
D. CH3CH2Br→ CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应为:4M + nO2 + 2nH2O = 4M(OH)n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是
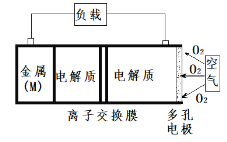
A.多孔电极有利于氧气扩散至电极表面,可提高反应速率
B.电池放电过程的正极反应式: O2 + 2H2O + 4e- = 4OH-
C.比较Mg、Al二种金属-空气电池,“理论比能量”之比是8∶9
D.为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:

(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。

① 溶液a呈酸性,原因是______。
② 根据如图所示的溶解度曲线,将溶液a______(填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
化合物 | ZnCl2 | NH4Cl |
熔点 | 365℃ | 337.8℃分解 |
沸点 | 732℃ | ------------- |
根据上表,设计方案提纯NH4Cl:________。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______(填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语错误的是
A.闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+=CuS + Zn2+
B.0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C.电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e-=H2↑+ 2OH-
D.钢铁发生吸氧腐蚀,负极反应为:Fe-3e-= Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如下实验测定海带中碘元素的含量,依次经过以下四个步骤,下列图示装置和原理能达到实验目的的是
A.灼烧海带
B.将海带灰溶解后分离出不溶性杂质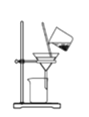
C.制备Cl2,并将I-氧化为I2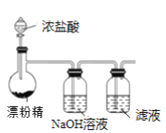
D.以淀粉为指示剂,用Na2SO3标准溶液滴定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com