
【题目】下列解释事实的化学用语错误的是
A.闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+=CuS + Zn2+
B.0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C.电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e-=H2↑+ 2OH-
D.钢铁发生吸氧腐蚀,负极反应为:Fe-3e-= Fe3+
【答案】D
【解析】
A.溶解度大的物质可以转化为溶解度小的物质,溶解度ZnS>CuS,则闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS),反应的离子方程式为ZnS+Cu2+=CuS+Zn2+,故A正确;
B.0.1mol/L醋酸溶液的pH约为3,说明醋酸为弱酸,部分电离,电离方程式为CH3COOHCH3COO-+H+,故B正确;
C.电解NaCl溶液时,阴极上水得电子生成氢气和氢氧根离子,离子方程式为2H2O+2e-=H2↑+2OH-,阴极区溶液pH增大,故C正确;
D.钢铁发生吸氧腐蚀时,负极上Fe失电子生成亚铁离子,电极反应式为Fe-2e-=Fe2+,故D错误;
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】四氯化锡(SnCl4)常作有机合成的催化剂,在空气中极易水解生成SnO2·xH2O,实验室用熔融的锡(熔点为231.9℃)与氯气反应来制备(同时有SnCl2生成),该反应是放热反应。可选用的仪器及装置如图所示。
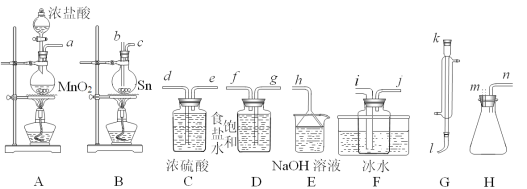
SnCl2、SnCl4有关物理性质如表:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 623 |
SnCl4 | 无色液体 | -33 | 114 |
(1)已知SnCl2、SnCl4晶体类型相同,SnCl2熔沸点高于SnCl4的原因是:___。
(2)选择装置进行连接(填各接口的字母,装置可重复使用,空格可不填满)。___
a→__,__→__,__→__,__→__,__→__,__→__,__→__,__→__。
(3)反应开始时,应先点燃装置___(填“A”或“B”,下同)的酒精灯,待___时,再点然装置___的酒精灯,并在反应进行中仍持续加热,其目的是___。
(4)该方法制得的SnCl4中含有少量SnCl2,提纯SnCl4的实验名称是___。
(5)测定产品纯度。取ag产品溶于少量浓盐酸,加入蒸馏水稀释至250mL。取20mL稀释溶液于锥形瓶,滴加几滴淀粉溶液,用cmol·L-1I2溶液滴定至终点,消耗滴定溶液V mL。
①该产品中SnCl2含量为___%。(滴定反应:Sn2++I2=Sn4++2I-,SnCl2的相对分子质量为:190)
②若操作时间过长、振荡剧烈,测得产品中SnCl4含量__(填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SBP电解法能大幅度提高电解槽的生产能力,如图为SBP电解法制备MoO3的示意图,下列说法错误的是( )
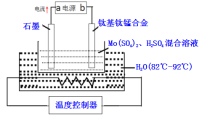
A.a极为电源的负极,发生氧化反应
B.电路中转移4mol电子,则石墨电极上产生标准状况下22.4LO2
C.钛基钛锰合金电极发生的电极反应为:3H2O+Mo4+-2e-=MoO3+6H+
D.电路中电子流向为:a极![]() 石墨,钛基钛锰电极
石墨,钛基钛锰电极![]() b极
b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于______(填写“六方”、“面心立方”或“体心立方”)。
(2)B-的电子排布式为____________,在CB3分子中C元素原子的原子轨道发生的是___________杂化。
(3)C的氢化物的空间构型为____________________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是________________________。
(4)B元素的电负性_______D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明___________。
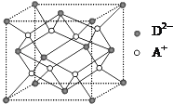
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为_______。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚为原料合成 ![]() 的路线如图所示。请按要求作答
的路线如图所示。请按要求作答

(1)写出苯酚制取A的有机物的有关反应方程式:______。
(2)写出以下物质的结构简式:B__________,F____________。
(3)写出反应④的化学反应方程式:④________,反应类型:_____。
(4)反应⑤可以得到E,同时可能得到的副产物的结构简式为_______。
(5)写出反应⑦的反应条件:__________,_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯),下列说法正确的是( )
Si(纯),下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1 mol Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应历程如下图所示,下列说法不正确的是( )
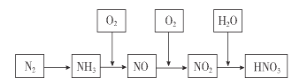
A. 氨可用作制冷剂
B. 铵态氮肥一般不能与碱性化肥共同使用
C. 硝酸可用于制化肥、农药、炸药、染料、盐类等
D. 某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为![]() n-,下列说法正确的是( )
n-,下列说法正确的是( )
A.![]() n-中含有的中子数为a+b
n-中含有的中子数为a+b
B.![]() n-中含有的电子数为a-n
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 在周期表所列元素中电负性最大 |
d | 位于周期表中第4纵行 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于________区的元素,其基态原子的价电子排布图为_________。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为________(用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有________种,任意画出一种________。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为________(用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为________;A的中心原子的轨道杂化类型为________;与A互为等电子体的一种分子为________(填化学式)。
(5)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为________,若该晶体的相对分子质量为M,密度为ag/cm![]() ,则晶胞的体积为________(NA用表示阿伏加德罗常数的值)。
,则晶胞的体积为________(NA用表示阿伏加德罗常数的值)。
(6)a形成的某种单质的层状结构如图,其中a原子数、a—a键数、六元环数之比为____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com