
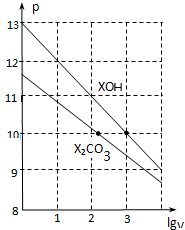
| A. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| B. | 已知常温下,0.1 mol•L-1 XHCO3溶液的pH=8.31,则Ka1(H2CO3)•Ka2(H2CO3)>Kw | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 |
分析 A.XOH是强碱溶液、X2CO3是强碱弱酸盐溶液,要使两种溶液的pH相等,则c(XOH)<c(X2CO3),再结合物料守恒判断;
B.0.1 mol•L-1 XHCO3溶液的pH=8.31,HCO3-在溶液中存在电离,也存在水解,且水解大于电离,列出平衡常数表达式,代入氢离子浓度和氢氧根离子浓度,进而比较Ka1(H2CO3)•Ka2(H2CO3)与Kw的大小关系;
C.0.10mol/LX2CO3溶液的pH=11.6,则该溶液中c(OH-)=c(HCO3-)=$\frac{1{0}^{-14}}{1{0}^{-11.6}}$mol/L=10-2.4 mol/L,c(CO32-)=0.1mol/L,
Kh1=$\frac{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Kw}{{K}_{a2}}$,则Ka2=$\frac{Kw}{{K}_{h1}}$=$\frac{Kwc(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}$;
D.当lgV=2时,则溶液的体积变为原来的100倍,升高温度,促进水解,第一步水解程度远远大于第二步,所以溶液中c(CO32-)减小,c(HCO3-)增大.
解答 解:A.XOH是强碱溶液、X2CO3是强碱弱酸盐溶液,要使两种溶液的pH相等,则c(XOH)<c(X2CO3),再结合物料守恒得c(X+):XOH小于X2CO3,故A错误;
B.0.1 mol•L-1 XHCO3溶液的pH=8.31,HCO3-在溶液中存在电离,也存在水解,且水解大于电离,HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,
故Kb=$\frac{[HC{{O}_{3}}^{-}][O{H}^{-}]}{[HC{{O}_{3}}^{-}]}$>$\frac{[{H}^{+}][C{{O}_{3}}^{2-}]}{[HC{{O}_{3}}^{-}]}$=Ka2,在碳酸中,Ka1=$\frac{[{H}^{+}][HC{{O}_{3}}^{-}]}{[{H}_{2}C{O}_{3}]}$,Ka2=$\frac{[{H}^{+}][C{{O}_{3}}^{2-}]}{[HC{{O}_{3}}^{-}]}$,故Ka1•Ka2<Kb•Ka1,所以Ka1•Ka2<$\frac{[HC{{O}_{3}}^{-}][O{H}^{-}]}{[HC{{O}_{3}}^{-}]}$•$\frac{[{H}^{+}][HC{{O}_{3}}^{-}]}{[{H}_{2}C{O}_{3}]}$,所以Ka1•Ka2<Kw,故B错误;
C.0.10mol/LX2CO3溶液的pH=11.6,则该溶液中c(OH-)=c(HCO3-)=-)=$\frac{1{0}^{-14}}{1{0}^{-11.6}}$mol/L=10-2.4 mol/L,c(CO32-)=0.1mol/L,Kh1=$\frac{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Kw}{{K}_{a2}}$,则Ka2=$\frac{Kw}{{K}_{h1}}$=$\frac{Kwc(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-}).c(O{H}^{-})}$=$\frac{1{0}^{-14}×0.1}{1{0}^{-2.4}×1{0}^{-2.4}}$=1.0×10-10.2,故C正确;
D.当lgV=2时,则溶液的体积变为原来的100倍,升高温度,促进水解,第一步水解程度远远大于第二步,所以溶液中c(CO32-)减小,c(HCO3-)增大,所以$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$增大,故D错误;
故选C.
点评 本题考查弱电解质电离与水解平衡的图象分析,侧重考查学生分析判断及计算能力,为高频考点,明确电离平衡常数与水解平衡常数的关系是解本题关键,难度较大.


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:多选题
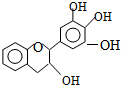 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC下列叙述中正确的是( )| A. | 分子中所有的原子不可能完全共面 | B. | 1molEGC与4molNaOH恰好完全反应 | ||
| C. | 易发生水解反应和取代反应 | D. | 遇FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
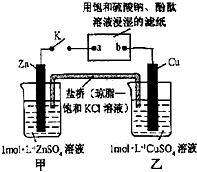
| A. | Cu电极上发生还原反应 | B. | 电子沿Zn→a→b→Cu路径流动 | ||
| C. | 片刻后甲池中c(SO42-)增大 | D. | 片刻后可观察到滤纸b点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Br-、Ba2+ | B. | Na+、SO32-、SO42-、K+ | ||
| C. | K+、MnO4-、NO3-、Na+ | D. | K+、Ca2+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 四联苯(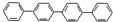 )的一氯代物有4种 )的一氯代物有4种 | |
| B. | 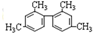 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| C. | 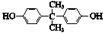 与 与 互为同系物 互为同系物 | |
| D. | 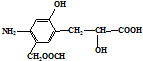 可以发生加成、取代、中和、消去反应 可以发生加成、取代、中和、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
周期 主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ④ | |||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C30H50 | B. | C30H56 | C. | C36H72 | D. | C30H60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
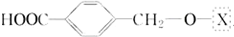 ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生. .
. (其中两种).
(其中两种). 为主要原料制备
为主要原料制备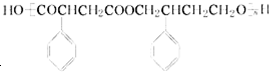 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com