
【题目】绿色化学对于化学反应提出了“原子经济性”的要求。理想的原子经济性反应是原料中的原子全部转化为产物,不产生副产品,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是( )
A.![]() +C2H5Cl→
+C2H5Cl→![]() +HCl
+HCl
B.![]() +C2H5OH→
+C2H5OH→![]() +H2O
+H2O
C.![]() +CH2=CH2→
+CH2=CH2→![]()
D.![]() +CH3CH3→
+CH3CH3→![]() +HCl
+HCl
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度均降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.NaClO;c.NaHCO3;d.NaOH。其溶液物质的量浓度由小到大顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)= 2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
A.①②④B.③④⑥C.④⑤⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )

A. 正极的电极反应式为:2H2O+O2+4e-=4OH-
B. SO42-与H2的反应可表示为:4H2+SO42--8e S2-+4H2O
S2-+4H2O
C. 钢管腐蚀的直接产物中含有FeS、Fe(OH)2
D. 在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是( )

A.混合溶液的导电能力与离子浓度和种类有关
B.b点的混合溶液pH=7
C.Na+与A2的导电能力之和大于HA的
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。

①343K时反应的平衡转化率α=___%。平衡常数K343K=__(保留2位小数)。
②在343K下:要提高SiHCl3转化率,可采取的措施是__;要缩短反应达到平衡的时间,可采取的措施有___、___。
③比较a、b处反应速率大小:va___vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=![]() -
-![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =___(保留1位小数)。
=___(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
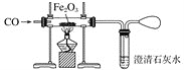
(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,t℃时发生反应:N2(g)+3H2(g)![]() 2NH3(g),在体系中,n(N2)随时间的变化如下表:
2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第5min时,N2的转化率为_______________________;
(2)用H2表示从0~2 min内该反应的平均速率v(H2)=_____________;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为______________。(用字母填空,下同);
a.v(NH3)=0.05 mol·L-1·min-1 b.v(H2)=0.03 mol·L-1·min-1
c.v(N2)=0.02 mol·L-1·min-1 d.v(H2)=0.00 l mol·L-1·s-1
(4)下列表述能作为反应达到化学平衡状态的标志是_____________。
a.反应速率v(N2):v(H2):v(NH3)=1:3:2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.单位时间内生成n mol N2的同时,生成3n mol H2
f.v(N2)消耗=2v(NH3)消耗
g.单位时间内3mol H—H键断裂的同时2mol N—H键也断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物M的分子式为C9H12,其中可能含有苯环的结构有![]() 、
、 、
、 等,下列说法错误的是
等,下列说法错误的是
A.有机物M不管是否含有苯环,在一定条件下都能发生氧化反应
B.有机物M的一种结构为![]() 该有机物不能与溴单质发生加成反应
该有机物不能与溴单质发生加成反应
C.除了上述三种物质,M的含苯环的同分异构体还有5种(不考虑立体异构)
D.![]() 与苯互为同系物
与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究第ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①②③④处依次放置蘸有NaBr溶液、淀粉碘化钾溶液、NaOH浓溶液和品红溶液的棉球。

(1)写出装置B中指定仪器的名称a________,b_________。
(2)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。依据该原理需要选择A、B、C装置中的________装置制取氯气。
(3)反应装置的导气管连接装置D的________(填“X”或“Y”)导管,试回答下列问题
①处所发生反应的离子方程式:____________________;
②处的现象:____________________;
③处所发生反应的离子方程式:__________________________。
(4)装置D中④的作用是__________________。
(5)某同学根据①②两处棉球颜色的变化得出结论:Cl、Br、I原子的得电子能力依次减弱。上述实验现象________(填“能”或“不能”)证明该结论、理由是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com