
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。

①343K时反应的平衡转化率α=___%。平衡常数K343K=__(保留2位小数)。
②在343K下:要提高SiHCl3转化率,可采取的措施是__;要缩短反应达到平衡的时间,可采取的措施有___、___。
③比较a、b处反应速率大小:va___vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=![]() -
-![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =___(保留1位小数)。
=___(保留1位小数)。
【答案】22 0.02 及时移去产物 改进催化剂 提高反应物压强(浓度) 大于 1.3
【解析】
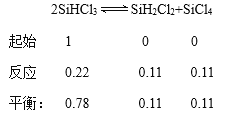
①根据三段式,求转化率和平衡常数:
②温度不变,提高三氯氢硅转化率的方法可以是将产物从体系分离(两边物质的量相等,压强不影响平衡);缩短达到平衡的时间,就是加快反应速率。
③a、b两点的转化率相等,可以认为各物质的浓度对应相等,而a点的温度更高,所以速率更快,即Va>Vb,当反应达平衡时v正=v逆,v正=![]() =v逆=
=v逆=![]() ,所以
,所以
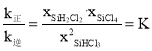 ,所以
,所以![]() 0.02,a点时,转化率为20%,根据三段式计算。
0.02,a点时,转化率为20%,根据三段式计算。
①根据三段式:

则343K时反应的平衡转化率为:![]() ,平衡常数K=0.112÷0.782=0.02,故答案为:22;0.22。
,平衡常数K=0.112÷0.782=0.02,故答案为:22;0.22。
②温度不变,提高三氯氢硅转化率的方法可以是将产物从体系分离(两边物质的量相等,压强不影响平衡)。缩短达到平衡的时间,就是加快反应速率,所以可以采取的措施是增大压强(增大反应物浓度)、加入更高效的催化剂(改进催化剂),故答案为:及时移去产物;改进催化剂、提高反应物压强(浓度)。
③a、b两点的转化率相等,可以认为各物质的浓度对应相等,而a点的温度更高,所以速率更快,即Va>Vb,当反应达平衡时v正=v逆,v正=![]() =v逆=
=v逆=![]() ,所以
,所以
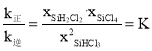 ,所以
,所以![]() 0.02,a点时,转化率为20%,所以计算出:
0.02,a点时,转化率为20%,所以计算出:

所以![]() =0.8;
=0.8;![]() ,所以
,所以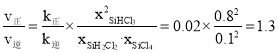 ,故答案为:大于;1.3。
,故答案为:大于;1.3。


科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基本化工原料,实验小组同学欲制备乙烯并验证其与溴单质的反应类型为加成反应。
I.乙烯的制备
欲利用下图所给装置制备乙烯。反应原理为:CH3CH2OH ![]() CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
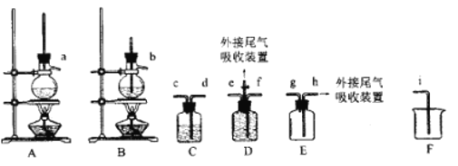
(1)欲收集一瓶乙烯,选择上图中的装置,其连接顺序为_____(按气流方向,用小写字母表示)。
(2)C中盛放的试剂为______,其作用为_____。
(3)在烧杯中混合浓硫酸和乙醇时,应先添加___;实验开始一段时间后发现忘记加碎瓷片,此时应该进行的操作为____。
(4)尾气吸收可采用________(填选项字母)。
A.KMnO4酸性溶液 B.浓硫酸 C.饱和Na2CO3溶液 D.NaOH溶液
II.验证乙烯与溴单质的反应类型为加成反应。
实验小组同学将I中制得的乙烯干燥后,按下列两种方案进行实验。
方案 | 操作 | 现象 |
一 | 将纯净的乙烯通入溴水中 | 溴水褪色 |
二 | 向充满纯净乙烯的塑料瓶中注入适量溴的CC14溶液,振荡 | ①溴的CCl4溶液褪色 ② |
(5)乙烯与溴单质发生加成反应的化学方程式为_________。
(6)方案一不能证明乙烯与溴单质发生了加成反应,原因为_________。
(7)方案二中现象②应为______,要想用此方案证明乙烯与溴单质发生的反应是加成反应,还需补充的实验为:继续向方案二塑料瓶中加入少量______,振荡后,若_____,证明发生了加成反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是
A.氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
B.已知2C(石墨,s)+O2(g)===2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
D.已知C(石墨,s)==C(金刚石,s)ΔH>0,则石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学的核心内容之一是“原子经济”,即反应物的原子全部转化为所期望的最终产物,原子利用率为100%.以下制备反应中最符合“原子经济”要求的是
A.甲烷与氯气制备一氯甲烷B.![]() 与消石灰反应制取漂白粉
与消石灰反应制取漂白粉
C.铜和浓硝酸反应制取硝酸铜D.CH3C![]() CH+CO+CH3OH
CH+CO+CH3OH![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al![]() Al3+
Al3+![]() Al(OH)3↓
Al(OH)3↓
方案2:Al![]() AlO
AlO![]()
![]() Al(OH)3↓
Al(OH)3↓
方案3: ―→Al(OH)3
―→Al(OH)3
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案________。
(Ⅱ)工业上冶炼铝的流程图如图所示:

在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:

(1)书写化学方程式,反应①________,反应②________。
(2)电解氧化铝生产铝时,阳极的电极反应式为_______________________________________。
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学对于化学反应提出了“原子经济性”的要求。理想的原子经济性反应是原料中的原子全部转化为产物,不产生副产品,实现零排放。下列几种生产乙苯的方法中,原子经济性最好的是( )
A.![]() +C2H5Cl→
+C2H5Cl→![]() +HCl
+HCl
B.![]() +C2H5OH→
+C2H5OH→![]() +H2O
+H2O
C.![]() +CH2=CH2→
+CH2=CH2→![]()
D.![]() +CH3CH3→
+CH3CH3→![]() +HCl
+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队报道了以LiAlCl4离子液体作为电解质的铝离子二次电池,其放电工作原理如图所示。下列说法错误的是( )
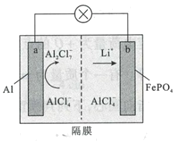
A.充电时,b极质量减小
B.放电时,阴离子向a极移动
C.充电时,正极反应为4Al2C1![]() +3e-=Al+7AlCl4
+3e-=Al+7AlCl4
D.放电时,阴极反应为FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是氧化铝(Al2O3),在工业上是采用电解氧化铝的方法得出金属铝。
(1)在氧化铝中铝元素与氧元素的质量之比是__________?
(2)用两种方法计算用170 t含氧化铝80%的铝土矿,理论上可冶炼出金属铝__________吨?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)![]() CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如下图所示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如下图所示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
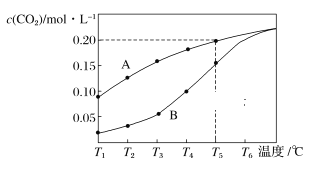
(1)该反应正反应为______(填“吸”或“放”)热反应,温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平衡常数数值为________。
(2)如果该反应的平衡常数K值变大,该反应________(选填字母)。
a.一定向逆反应方向移动
b.在平衡移动时正反应速率先增大后减小
c.一定向正反应方向移动
d.在平衡移动时逆反应速率先减小后增大
(3)保持温度、体积不变,充入CO2气体,则CaCO3的质量______,CaO的质量______CO2的浓度________(填“增大”,“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com