
【题目】下列有关热化学方程式及其叙述正确的是
A.氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
B.已知2C(石墨,s)+O2(g)===2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
D.已知C(石墨,s)==C(金刚石,s)ΔH>0,则石墨比金刚石稳定
【答案】D
【解析】
A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式方向改变,焓变符号随之变化;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
C.反应是可逆反应不能进行彻底;
D.物质具有的能量越低越稳定,吸热反应,产物的能量高于反应物的能量;
A.氢气的燃烧热为285.5 kJmol-1,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,则水分解的热化学方程式为:H2O(l)=H2(g)+0.5O2(g)△H=+285.5 kJmol-1,A项错误;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJmol-1,是的氧化物不稳定,则石墨的燃烧热大于110.5 kJmol-1,B项错误;
C.已知N2(g)+3H2(g)![]() 2 NH3(g);△H=-92.4 kJmol-1,反应是可逆反应,则在一定条件下将1molN2和3molH2置于一密闭容器中充分反应后,放出热量小于92.4kJ,C项错误;
2 NH3(g);△H=-92.4 kJmol-1,反应是可逆反应,则在一定条件下将1molN2和3molH2置于一密闭容器中充分反应后,放出热量小于92.4kJ,C项错误;
D. C(石墨s)=C(金刚石s)△H>0,可知石墨转化为金刚石吸热,即金刚石的总能量高,能量越高越不稳定,则石墨比金刚石稳定,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】将V1mL 1.0 mol·L-1盐酸溶液和V2mL未知浓度的氢氧化钠溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
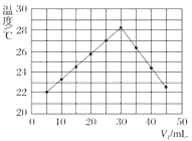
下列叙述正确的是( )
A.做该实验时环境温度为20 ℃
B.该实验表明化学能可能转化为热能
C.氢氧化钠溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式________。
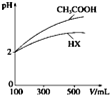
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)。
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中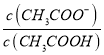 =____________。
=____________。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院深圳研究院成功研发出一种基于二硫化钼/碳纳米复合材料的钠型双离子电池,可充放电。其放电时工作原理如图所示。下列说法不正确的是( )
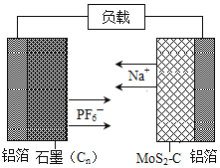
A.二硫化钼/碳纳米复合材料为该电池的负极材料
B.放电时正极的反应式为Cn(PF6)x+xe-═xPF6-+Cn
C.充电时阴极的电极反应式为MoS2-C+xNa++xe-=NaxMoS2-C
D.充电时石墨端铝箔连接外接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗高磷酸盐血症。某化学小组用如图装置模拟制备碳酸镧,反应为2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O,下列说法正确的是( )
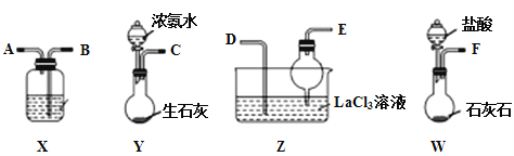
A.从左向右接口的连接顺序:F→B,A→D,E←C
B.装置X中盛放的试剂为饱和Na2CO3溶液
C.装置Z中用干燥管的主要目的是增大接触面积,加快气体溶解
D.实验开始时应先打开Y中分液漏斗的旋转活塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )

A. 正极的电极反应式为:2H2O+O2+4e-=4OH-
B. SO42-与H2的反应可表示为:4H2+SO42--8e S2-+4H2O
S2-+4H2O
C. 钢管腐蚀的直接产物中含有FeS、Fe(OH)2
D. 在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
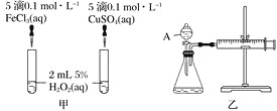
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
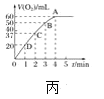
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。

①343K时反应的平衡转化率α=___%。平衡常数K343K=__(保留2位小数)。
②在343K下:要提高SiHCl3转化率,可采取的措施是__;要缩短反应达到平衡的时间,可采取的措施有___、___。
③比较a、b处反应速率大小:va___vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=![]() -
-![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =___(保留1位小数)。
=___(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验装置和操作,回答有关问题。

按图中所示装置,用两种不同的操作分别进行实验,观察B容器中的现象。
(1)先夹紧止水夹a,再使A容器中开始反应:①实验中B容器中观察到的现象是_________________;
②B容器中发生反应的离子方程式是____________________________________。
(2)打开止水夹a,使A容器开始反应一段时间后再夹紧止水夹a,①实验中观察到的现象是__________;②B容器中发生反应的离子方程式是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com