
【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式________。
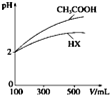
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)。
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中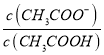 =____________。
=____________。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。
【答案】2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ 小于 > 碱性 > 18 = ![]()
【解析】
(1)氯化铝溶液和碳酸钠溶液混合,发生盐的双水解反应,产生白色氢氧化铝沉淀和二氧化碳气体;
(2)据图分析,加水稀释的过程中,酸HX的pH变化比较慢,说明HX的酸性比醋酸弱;根据电荷守恒分析、比较溶液中离子数目关系;
(3)①比较HCN的电离平衡常数和CN-的水解平衡常数判断溶液的酸碱性;
②结合醋酸的电离平衡常数计算;
(4)根据电荷守恒分析比较离子浓度关系,结合弱电解质电离平衡常数分析一水合氨的电离平衡常数。
(1)氯化铝溶液和碳酸钠溶液混合,发生盐的双水解反应,产生白色氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;
(2)据图分析,加水稀释的过程中,HX的pH变化比较小,说明HX的酸性比醋酸弱,酸性越弱,在相同外界条件下,酸的电离平衡常数越小,所以HX的电离平衡常数小于醋酸的电离平衡常数;
根据电荷守恒,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),c(X-)+c(OH-)=c(Na+)+c(H+),即离子总数是c(Na+)+c(H+)的2倍,而NaX的水解程度大,即NaX溶液中的c(OH-)大,则其溶液中c(H+)小,而c(Na+)相同,所以乙酸钠中离子总浓度大些;
(3)①25 ℃时,HCN的电离平衡常数Ka=4.9×10-10,而NaCN的水解平衡常数Kh=![]() =2.0×10-5> Ka=4.9×10-10,水解程度大于其电离程度,所以溶液显碱性;CN-水解产生HCN,所以微粒浓度c(HCN)>c(CN-);
=2.0×10-5> Ka=4.9×10-10,水解程度大于其电离程度,所以溶液显碱性;CN-水解产生HCN,所以微粒浓度c(HCN)>c(CN-);
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中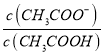 =
=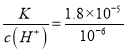 =18;
=18;
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,在该溶液中存在电荷守恒,c(H+)+c(NH4+)=c(Cl-)+c(OH-),由于溶液显中性,所以c(H+)=c(OH-),则c(NH4+)=c(Cl-);NH3·H2O在溶液中存在电离平衡:NH3·H2O![]() NH4++OH-,NH3·H2O的电离平衡常数K=
NH4++OH-,NH3·H2O的电离平衡常数K=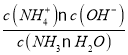 =
=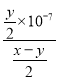 =
=![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题。
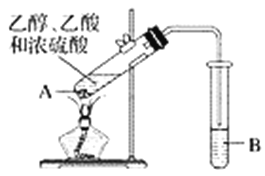
(1)试管A混合溶液的加入顺序是__________________________________。
(2)试管A中加入几块碎瓷片的目的是______________________。
(3)试管A中发生反应的化学方程式为______________,反应类型是__________。
(4)反应开始前,试管B中盛放的溶液是_______________________。
(5)试管B中可能观察到的现象是______________________________。
(6)将试管B中的物质分离得到乙酸乙酯,必须使用的仪器是________,具体操作是将乙酸乙酯从该仪器的________________________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔥醌(AQDS)是一种具有氧化还原活性的廉价有机分子,蔥醌/碘化铵液流可充电电池(如图)以其环保、价廉、稳定等优点被研究及广泛应用。充电时,AQDS转化为AQDS (NH4)2。 下列说法错误的是
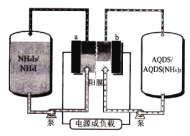
A.放电时 ,b极电势低于a极
B.充电时,a极的电极反应式为:3I--2e-= I3-
C.充电时,电路中每转移1 mole-, 膜两侧电解液的质量变化差为36 g
D.该装置中的阳膜也可以用阴膜代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基本化工原料,实验小组同学欲制备乙烯并验证其与溴单质的反应类型为加成反应。
I.乙烯的制备
欲利用下图所给装置制备乙烯。反应原理为:CH3CH2OH ![]() CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
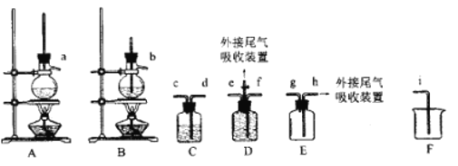
(1)欲收集一瓶乙烯,选择上图中的装置,其连接顺序为_____(按气流方向,用小写字母表示)。
(2)C中盛放的试剂为______,其作用为_____。
(3)在烧杯中混合浓硫酸和乙醇时,应先添加___;实验开始一段时间后发现忘记加碎瓷片,此时应该进行的操作为____。
(4)尾气吸收可采用________(填选项字母)。
A.KMnO4酸性溶液 B.浓硫酸 C.饱和Na2CO3溶液 D.NaOH溶液
II.验证乙烯与溴单质的反应类型为加成反应。
实验小组同学将I中制得的乙烯干燥后,按下列两种方案进行实验。
方案 | 操作 | 现象 |
一 | 将纯净的乙烯通入溴水中 | 溴水褪色 |
二 | 向充满纯净乙烯的塑料瓶中注入适量溴的CC14溶液,振荡 | ①溴的CCl4溶液褪色 ② |
(5)乙烯与溴单质发生加成反应的化学方程式为_________。
(6)方案一不能证明乙烯与溴单质发生了加成反应,原因为_________。
(7)方案二中现象②应为______,要想用此方案证明乙烯与溴单质发生的反应是加成反应,还需补充的实验为:继续向方案二塑料瓶中加入少量______,振荡后,若_____,证明发生了加成反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
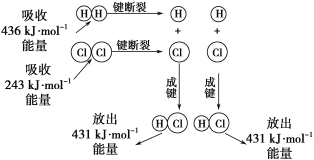
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期元素R、X、Y、Z、T。R与T原子最外层电子数均是电子层数的2倍;Y元素能与大多数金属和非金属元素形成化合物;Z+与Y2-电子层结构相同。五种元素的原子半径与原子序数的关系如图所示,下列推断正确的是

A. Y、Z组成的化合物只含离子键
B. 氢化物的沸点:Y < X
C. T、R的最高价氧化物对应的水化物的酸性T比R的强
D. Y分别与T、X组成的二元化合物的水溶液一定是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中发生反应C(s)+H2O(g)![]() CO(g)+H2(g),下列状态中不能表明该反应达到平衡状态的是( )
CO(g)+H2(g),下列状态中不能表明该反应达到平衡状态的是( )
A.断裂氢氧键速率是断裂氢氢键速率的2倍
B.混合气体平均相对分子质量不再改变
C.单位时间内消耗水与生成氢气的质量比为9∶1
D.混合气体的物质的量不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是
A.氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
B.已知2C(石墨,s)+O2(g)===2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
D.已知C(石墨,s)==C(金刚石,s)ΔH>0,则石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队报道了以LiAlCl4离子液体作为电解质的铝离子二次电池,其放电工作原理如图所示。下列说法错误的是( )
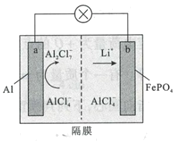
A.充电时,b极质量减小
B.放电时,阴离子向a极移动
C.充电时,正极反应为4Al2C1![]() +3e-=Al+7AlCl4
+3e-=Al+7AlCl4
D.放电时,阴极反应为FePO4+Li++e-=LiFePO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com