
【题目】将V1mL 1.0 mol·L-1盐酸溶液和V2mL未知浓度的氢氧化钠溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
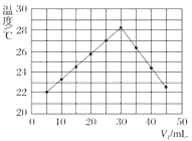
下列叙述正确的是( )
A.做该实验时环境温度为20 ℃
B.该实验表明化学能可能转化为热能
C.氢氧化钠溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A.用FeCl3溶液制作铜质印刷线路板:2Fe3++ Cu = Cu2++ 2Fe2+
B.Al片溶于NaOH溶液中产生气体:2Al + 2OH-=2![]() + H2↑
+ H2↑
C.用难溶的MnS除去MnCl2溶液中含有的Pb2+:MnS(s) + Pb2+(aq) =PbS (s) + Mn2+(aq)
D.向银氨溶液中滴加乙醛后水浴加热,出现银镜:CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题。
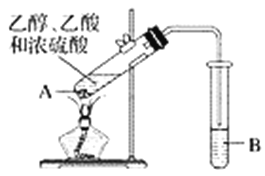
(1)试管A混合溶液的加入顺序是__________________________________。
(2)试管A中加入几块碎瓷片的目的是______________________。
(3)试管A中发生反应的化学方程式为______________,反应类型是__________。
(4)反应开始前,试管B中盛放的溶液是_______________________。
(5)试管B中可能观察到的现象是______________________________。
(6)将试管B中的物质分离得到乙酸乙酯,必须使用的仪器是________,具体操作是将乙酸乙酯从该仪器的________________________(填“下口放出”或“上口倒出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A. 容器内n(A2):n(B2):n(AB)=1:1:2
B. 容器内气体的密度不随时间变化
C. 容器内气体的总压强不随时间变化
D. 单位时间内生成2n mol AB,同时生成n mol A2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,不能达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 验证石蜡油分解的产物中含有与烷烃性质不同的烃 | 除去乙烯、甲烷混合气中的乙烯 | 比较Cl2、I2的氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如图:
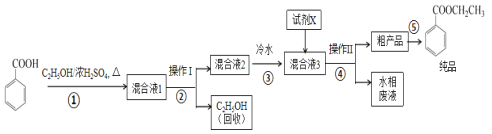
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为__。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入12.2g纯化后的苯甲酸晶体,30mL无水乙醇(约0.5mol)和3mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2h。仪器A的作用是__。
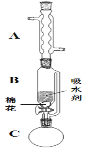
(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为__。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_;操作II所用的玻璃仪器除了烧杯外还有__。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有__;加入试剂X为___(填写化学式)。
(6)最终得到产物纯品10.0g,实验产率为__%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔥醌(AQDS)是一种具有氧化还原活性的廉价有机分子,蔥醌/碘化铵液流可充电电池(如图)以其环保、价廉、稳定等优点被研究及广泛应用。充电时,AQDS转化为AQDS (NH4)2。 下列说法错误的是
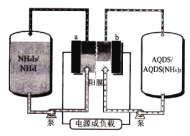
A.放电时 ,b极电势低于a极
B.充电时,a极的电极反应式为:3I--2e-= I3-
C.充电时,电路中每转移1 mole-, 膜两侧电解液的质量变化差为36 g
D.该装置中的阳膜也可以用阴膜代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基本化工原料,实验小组同学欲制备乙烯并验证其与溴单质的反应类型为加成反应。
I.乙烯的制备
欲利用下图所给装置制备乙烯。反应原理为:CH3CH2OH ![]() CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
CH2=CH2↑+H2O,反应过程中观察到蒸馏烧瓶中溶液逐渐变黑。
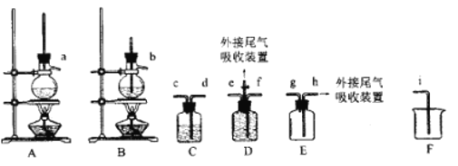
(1)欲收集一瓶乙烯,选择上图中的装置,其连接顺序为_____(按气流方向,用小写字母表示)。
(2)C中盛放的试剂为______,其作用为_____。
(3)在烧杯中混合浓硫酸和乙醇时,应先添加___;实验开始一段时间后发现忘记加碎瓷片,此时应该进行的操作为____。
(4)尾气吸收可采用________(填选项字母)。
A.KMnO4酸性溶液 B.浓硫酸 C.饱和Na2CO3溶液 D.NaOH溶液
II.验证乙烯与溴单质的反应类型为加成反应。
实验小组同学将I中制得的乙烯干燥后,按下列两种方案进行实验。
方案 | 操作 | 现象 |
一 | 将纯净的乙烯通入溴水中 | 溴水褪色 |
二 | 向充满纯净乙烯的塑料瓶中注入适量溴的CC14溶液,振荡 | ①溴的CCl4溶液褪色 ② |
(5)乙烯与溴单质发生加成反应的化学方程式为_________。
(6)方案一不能证明乙烯与溴单质发生了加成反应,原因为_________。
(7)方案二中现象②应为______,要想用此方案证明乙烯与溴单质发生的反应是加成反应,还需补充的实验为:继续向方案二塑料瓶中加入少量______,振荡后,若_____,证明发生了加成反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是
A.氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
B.已知2C(石墨,s)+O2(g)===2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
D.已知C(石墨,s)==C(金刚石,s)ΔH>0,则石墨比金刚石稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com