
【题目】能源问题是当今世界上困扰人类发展的重大问题之一,下利能量转化不正确的是
A.电炉取暖是将电能转化为热能
B.酒精燃烧是将化学能转化热能
C.太阳能发电是将化学能转化为电能
D.手机充电是将电能转化为化学能
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的量浓度关系正确的是
A. pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH) < c(CH3COONa) < c(Na2CO3)
B. 已知0.1 mol·L-1 二元酸H2A溶液的pH=4,则在0.1 mol·L-1 Na2A溶液中:c(OH-) = c(HA-) + c(H+) + 2c(H2A)
C. 将0.1 mol·L-1醋酸溶液加水稀释,则溶液中的c(H+)和c(OH-)都减小
D. 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3.H2O)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe(s) +CO2 (g)![]() FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是
FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为K=![]()
C. 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D. 该反应的正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ能够自发进行的条件是__________ (填“较低温度”、“ 较高温度”或“任何温度”)
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是__________。

A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,250℃时反应的平衡常数K=______;若要进一步提高甲醇体积分数。可采取的措施有_________________。
(6)下图是电解Na2CO3溶液的装置图。

阴极的电极反应式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将含有C.H、O的有机物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
(1)燃烧此化合物3.24g,须消耗氧气的质量是多少______?
(2)求此化合物的分子式______?(要有简单计算过程)
(3)该化合物1分子中存在1个苯环和1个羟基,试写出它的同分异构体的结构简式______。(计算要有文字说明过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用化学沉降法处理酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在),同时从沉渣中还可以提取出常用的中药药剂As2O3,基本实现了废水处理过程的“三废”零排放。工艺流如下:

回答下列问题:
(1)H3AsO3中,砷元素的化合价为__________
(2)H3AsO3是三元弱酸,第一步和第二步电离是通过和水中的OH-结合实现的,第三步则直接电离出H+,第一步电离方程式为H3AsO3+H2O![]() [As(OH)4]-+H+,则第二步电离方程式为________________________________。
[As(OH)4]-+H+,则第二步电离方程式为________________________________。
(3)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq); “一级沉砷”中FeSO4的作用是___________________________________________________
2AsS33-(aq); “一级沉砷”中FeSO4的作用是___________________________________________________
(4)“二级沉砷”后,滤渣A的主要成分,除含有Ca3(AsO4)2 、FeAsO4、Fe(OH)3外,还有________(写化学式)。
(5)写出Ⅳ过程中,由Na3AsO4制备As2O3 的离子方程式 ____________________________ 。
(6)砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 , K2=1.7×10-7 , K3=4.0×10-12, Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O![]() HAsO42-+OH-,该步水解的平衡常数(25℃)为__________(保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为__________(保留两位有效数字)。
(7)雌黄(As2S3)和雄黄(As4S4 )是自然界中常见的砷化物,一定条件下,两者的转化关系如下图所示。若反应Ⅱ中,1mol As4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图中,表示NO2变化曲线的是_______ 。用O2表示从0s ~2s内该反应的平均速率V=__________。
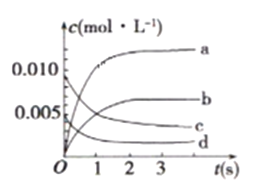
②能说明该反应已达到平衡状态的是___________
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.容器中氧气体积分数不变 D.容器内密度保持不变
(2)为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,试完成有关问题:
实验编号 | 电极材料 | 电解质溶液 |
1 | Al、Mg | 稀盐酸 |
2 | Al、Cu | 稀盐酸 |
3 | Al、C(石墨) | 稀盐酸 |
4 | Al、 | 氢氧化钠溶液 |
5 | Al、Zn | 浓硝酸 |
①实验1中Al所作的电极是______(填“正极”或“负极”)。
②实验2中H+移向______(填“Al”或“Cu”),Cu极发生_____反应(填“氧化”或“还原”)。
③实验3中石墨的电极反应式: _________________。
④实验4中铝作______极,写出总反应的化学方程式:_______________________。
⑤实验5中负极的电极反应式为:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种有机物:①乙烯 ②2-丙醇 ③ 甲苯 ④ 乙炔,其中:
(1)能发生消去反应的是_________(填序号,下同),其化学方程式是________。
(2)能衡量一个国家的石油化工生产水平的是__________,该物质可用于一种常用塑料,其反应的化学方程式是__________。
(3)能用来制取梯恩梯(TNT)的是________,其发生反应的化学方程式是________。
(4)碳元素的质量百分含量最高的是________,实验室制取该物质的反应装置如下:
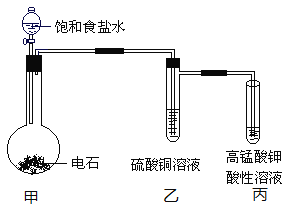
甲中反应的化学方程式是________,滴加饱和食盐水而不直接滴加水的原因是________,乙中硫酸铜溶液的作用是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com