解答:
解:(1)钠和水能反应生成氢氧化钠和氢气2Na+2H
2O=2NaOH+H
2↑.
故答案为:2Na+2H
2O=2NaOH+H
2↑.
(2)铁在高温下和水蒸气发生化学反应生成四氧化三铁和氢气,此反应的化学方程式为:3Fe+4H
2O
Fe
3O
4+4H
2,
故答案为:3Fe+4H
2O
Fe
3O
4+4H
2;
(3)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑,
故答案为:2Al+2NaOH+2H
2O=2NaAlO
2+3H
2↑;
(4)过氧化钠与二氧化碳反应生成碳酸钠和氧气,即2Na
2O
2+2CO
2=2Na
2CO
3+O
2,
故答案为:2Na
2O
2+2CO
2=2Na
2CO
3+O
2;
(5)一水合氨不会溶解氢氧化铝,氯化铝与氨水反应的化学方程式为:AlCl
3+3NH
3?H
2O═Al(OH)
3↓+3NH
4Cl
故答案为:AlCl
3+3NH
3?H
2O═Al(OH)
3↓+3NH
4Cl;
(6)氢氧化铝和氢氧化钠溶液的反应生成偏铝酸钠和水反应的化学方程式为:Al(OH)
3+NaOH=NaAlO
2+2H
2O;
故答案为:Al(OH)
3+NaOH=NaAlO
2+2H
2O;
(7)氯化铁溶液中滴加氢氧化钠溶液反应生成氢氧化铁沉淀和氯化钠,反应的化学方程式为:FeCl
3+3NaOH=Fe(OH)
3↓+3NaCl;
故答案为:FeCl
3+3NaOH=Fe(OH)
3↓+3NaCl;
(8)向偏铝酸钠溶液中滴加少量稀盐酸生成沉淀氢氧化铝,反应的化学方程式为:NaAlO
2+HCl+H
2O=Al(OH)
3↓+NaCl;
故答案为:NaAlO
2+HCl+H
2O=Al(OH)
3↓+NaCl;
(9)氢氧化亚铁被氧化生成氢氧化铁,反应的化学方程式为:4Fe(OH)
2+O
2+2H
2O=4Fe(OH)
3;
故答案为:4Fe(OH)
2+O
2+2H
2O=4Fe(OH)
3 ;
(10)碳酸氢钠受热分解生成碳酸钠、二氧化碳和水反应的化学方程式为:2NaHCO
3Na
2CO
3+CO
2↑+H
2O;
故答案为:2NaHCO
3Na
2CO
3+CO
2↑+H
2O;



 阅读快车系列答案
阅读快车系列答案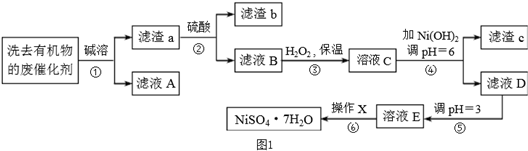

 A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D原子最外层电子数是电子层数的3倍,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族.已知D原子最外层电子数是电子层数的3倍,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质.