
| ||
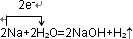 ,
,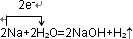 .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径Y>Z>W |
| B、Y氧化物属于酸性氧化物 |
| C、对应的氢化物的热稳定性:W>Z |
| D、X的最高价氧化物对应的水化物弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Fe与足量的稀硝酸反应,转移3nA个电子 |
| B、常温下,16g CH4含有8nA个电子(相对原子质量:C-12,H-1) |
| C、0.5 mol?L-1Na2CO3溶液中含有nA个Na+ |
| D、标准状况下,22.4L氯水含有nA个Cl2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O的摩尔质量是18 |
| B、等质量的O2和O3中所含的氧原子数相同 |
| C、常温下,22.4LNO2中所含的氧原子数为2NA |
| D、4gNaOH溶解于500mL水中,所得溶液的物质的量浓度为0.2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的铁粉与氯气反应生成FeCl3 |
| B、少量SO2通入Ca(ClO)2溶液生成CaSO3沉淀 |
| C、氯气能使润湿的淀粉碘化钾试纸变蓝 |
| D、次氯酸钙比次氯酸稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | pH (开始沉淀) | pH④ (完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、长期大量服用阿司匹林可预防疾病,没有毒副作用 |
| B、随着平价药房的开设,病人都可以到药店自行买药服用,不用到医院就诊 |
| C、随着平价药房的开设,病人都可以到药店自行买药服用,不用到医院就诊 |
| D、碘酒能使蛋白质变性,医院里常用于皮肤消毒. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com