

| 物质 | pH (开始沉淀) | pH④ (完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
| 250 |
| 25.00 |
0.20×V×10-3×5×
| ||
| 25×10-3 |
0.20×V×10-3×5×
| ||
| 25×10-3 |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
A、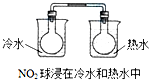 | ||||||||
B、
| ||||||||
C、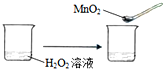 | ||||||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、NO3-、SiO32- |
| B、K+、Na+、Ba2+、SO42- |
| C、K+、Ca2+、Na+、CO32- |
| D、H+、NH4+、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①② | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化锰具有还原性,可用于实验室制备氯气 |
| B、Na2O2能与水或二氧化碳反应生成氧气,可用作供氧剂 |
| C、碳酸氢钠能与碱反应,可用作食品的膨松剂 |
| D、Na2SO4浓溶液能使蛋白质发生盐析,可用于杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | 过氧化钠 | |
| D | 吸收未反应的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,其工业合成路线如下:
,其工业合成路线如下:| CH3COOH |
| 催化剂 |
| X |
| C4H6O |
| Y |
| (C4H6O 2)n |
| CH3OH |

| 催化剂 |

| 一定条件 |
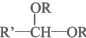 +H2O在横线上填入物质、在方框内填上系数完成聚乙烯醇转化为维纶的化学方程式.
+H2O在横线上填入物质、在方框内填上系数完成聚乙烯醇转化为维纶的化学方程式.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④②①③ | B、①③②④ |
| C、③②①④ | D、①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com