
| 选项 | 纯净物 | 酸性氧化物 | 碱性氧化物 | 酸 | 盐 |
| A | 碱石灰 | 二氧化硫 | 氧化铝 | 乙二酸 | 小苏打 |
| B | 五水硫酸铜 | 三氧化硫 | 氧化铜 | 油酸 | 苏打 |
| C | 过氧化氢 | 五氧化二磷 | 过氧化物 | 硬脂酸 | 碱式碳酸铜 |
| D | 盐酸 | 一氧化碳 | 氧化镁 | 冰醋酸 | 小苏打 |
| A. | A | B. | B | C. | C | D. | D |
分析 纯净物是指只有一种分子构成的物质;
酸性氧化物是指能与水作用生成酸或与碱作用生成盐和水的氧化物(且生成物只能有一种盐和水,不可以有任何其它物质生成);
碱性氧化物是指与水反应生成碱的氧化物或能跟酸起反应生成一种盐和水的氧化物(且生成物只能有盐和水,不可以有任何其它物质生成);
盐是由金属离子(或铵根离子)和酸根离子组成的化合物;
酸是指电离时产生的阳离子全部都是氢离子的化合物.
解答 解:A、碱石灰是氧化钙和氢氧化钠的混合物,氧化铝既能与酸反应,又能与碱反应,属于两性氧化物,故A错误;
B、五水硫酸铜是纯净物,三氧化硫属于酸性氧化物,氧化铜属于碱性氧化物,油酸属于酸,苏打属于盐,故B正确;
C、过氧化物能与酸反应生成盐、水和氧气,不是碱性氧化物,故C错误;
D、盐酸是氯化氢的混合物,CO属于不成盐氧化物,不是酸性氧化物,故D错误;
故选B;
点评 本题主要考查对酸、碱、盐的概念的了解和应用,解答时要根据酸碱盐概念方面进行分析、判断,从而得出正确的结论.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠俗称苏打 | |
| B. | 鉴别Na2CO3和NaHCO3两种无色溶液,可以分别滴加Ba(OH)2溶液,观察有无白色沉淀 | |
| C. | NaHCO3的热稳定性大于Na2CO3 | |
| D. | 向滴有酚酞试剂的水中加入足量的Na2O2粉末并振荡,溶液由无色变红最后又变无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中常用饱和食盐水除去Cl2中混有的HCl | |
| B. | 银器长期放置,表面变暗 | |
| C. | 红棕色的NO2加压后颜色先变深再变浅 | |
| D. | 氨水中加酸,NH4+的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 验证盐类的水解是否是吸热反应 | 向醋酸钠溶液中滴入酚酞试液,加热观察红色是否加深 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 青蒿素可溶于乙醚和水 | |
| B. | 青蒿素的晶体为分子晶体,化学式为C16H20O5 | |
| C. | 青蒿素与NaOH溶液不反应 | |
| D. | 青蒿素含有过氧键,一定条件下有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该浓硝酸中HNO3的物质的量浓度是12.0 mol/L | |
| B. | 该合金中铜与镁的物质的量之比是2:1 | |
| C. | NO2和N2O4的混合气体中,N2O4的体积分数是20% | |
| D. | 得到2.54g沉淀时,加入NaOH溶液的体积是6.0 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
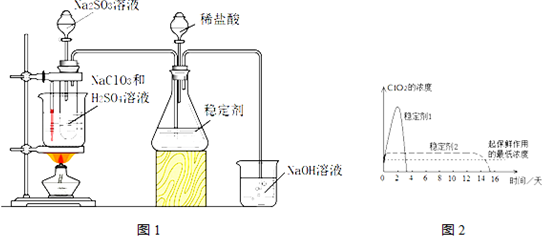
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
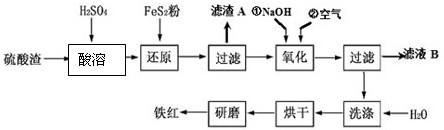
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com