
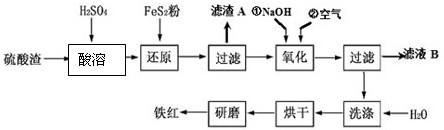
分析 硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,硫酸渣中加入稀硫酸,硫酸渣中Fe2O3、Al2O3、MgO都能溶于稀硫酸生成可溶性的硫酸盐,SiO2不和稀硫酸反应,加入FeS2,Fe3+和FeS2发生氧化还原反应生成Fe2+,然后过滤,滤渣A中主要成分是SiO2;滤液中含有Fe2+、Mg2+、Al3+,向滤液中加入NaOH、通入空气,且控制溶液pH,将Fe2+转化为Fe(OH)3沉淀,然后过滤,滤液B中含有Mg2+、Al3+,滤渣中含有Fe(OH)3,然后洗涤、烘干,烘干时Fe(OH)3分解生成Fe2O3,研磨得到Fe2O3即铁红,
(1)酸溶时,粉碎硫酸渣能增大反应物的接触面积;
(2)还原过程中加入FeS2粉增大溶液中Fe2+的含量,同时有H2SO4生成,根据反应物和生成物书写离子方程式;
(3)二氧化硅不易溶于稀硫酸;
(4)氢氧化铁吸附的阴离子有硫酸根离子,用盐酸酸化的氯化钡溶液检验硫酸根离子;
(5)若要使Mg2+完全沉淀则要保持c(OH-)≥$\sqrt{\frac{{K}_{sp}[Mg(OH)_{2}]}{c(M{g}^{2+})}}$.
解答 解:硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,硫酸渣中加入稀硫酸,硫酸渣中Fe2O3、Al2O3、MgO都能溶于稀硫酸生成可溶性的硫酸盐,SiO2不和稀硫酸反应,加入FeS2,Fe3+和FeS2发生氧化还原反应生成Fe2+,然后过滤,滤渣A中主要成分是SiO2;滤液中含有Fe2+、Mg2+、Al3+,向滤液中加入NaOH、通入空气,且控制溶液pH,将Fe2+转化为Fe(OH)3沉淀,然后过滤,滤液B中含有Mg2+、Al3+,滤渣中含有Fe(OH)3,然后洗涤、烘干,烘干时Fe(OH)3分解生成Fe2O3,研磨得到Fe2O3即铁红,
(1)酸溶时,粉碎硫酸渣能增大反应物的接触面积,能加快反应速率,故答案为:增大接触面积,加快溶解速率;
(2)还原过程中加入FeS2粉增大溶液中Fe2+的含量,同时有H2SO4生成,根据反应物和生成物书写离子方程式为FeS2+14 Fe3++8H2O=15Fe2++2SO42-+16H+,故答案为:FeS2+14 Fe3++8H2O=15Fe2++2SO42-+16H+;
(3)二氧化硅不易溶于稀硫酸,滤渣A的主要成分是SiO2,故答案为:SiO2;
(4)氢氧化铁吸附的阴离子有硫酸根离子,用盐酸酸化的氯化钡溶液检验硫酸根离子,其检验方法为取少量最后一次洗涤液于洁净的试管中,滴加少量BaCl2溶液,若无明显现象,则沉淀已洗净,
故答案为:取少量最后一次洗涤液于洁净的试管中,滴加少量BaCl2溶液,若无明显现象,则沉淀已洗净;
(5)若要使Mg2+完全沉淀则要保持c(OH-)≥$\sqrt{\frac{{K}_{sp}[Mg(OH)_{2}]}{c(M{g}^{2+})}}$=$\sqrt{\frac{5.6×1{0}^{-12}}{1{0}^{-5}}}$mol/L=7.5×10-4mol/L,
故答案为:7.5×10-4mol/L.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生知识综合应用能力,涉及化学反应速率影响因素、离子方程式的书写、离子检验、难溶物的溶解平衡等知识点,明确化学原理、离子方程式书写规则、离子检验方法是解本题关键,要明确流程图中各个步骤可能发生的反应、基本操作方法及所用仪器等,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 酸性氧化物 | 碱性氧化物 | 酸 | 盐 |
| A | 碱石灰 | 二氧化硫 | 氧化铝 | 乙二酸 | 小苏打 |
| B | 五水硫酸铜 | 三氧化硫 | 氧化铜 | 油酸 | 苏打 |
| C | 过氧化氢 | 五氧化二磷 | 过氧化物 | 硬脂酸 | 碱式碳酸铜 |
| D | 盐酸 | 一氧化碳 | 氧化镁 | 冰醋酸 | 小苏打 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的本质特征为均匀稳定 | |
| B. | 胶体和溶液可以通过丁达尔效应来鉴别 | |
| C. | 可以用饱和氯化铁溶液和氢氧化钠溶液混合来制取氢氧化铁胶体 | |
| D. | 可以用过滤的方法净化胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
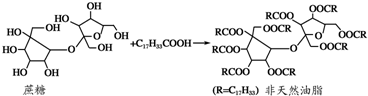
| A. | 该非天然油脂结构中含有2种官能团 | |
| B. | 油酸与蔗糖发生的反应类型属于取代反应 | |
| C. | 该非天然油脂能与氢氧化钠溶液、溴的四氯化碳溶液发生反应 | |
| D. | 蔗糖分子可以看作是两个不同的单糖分子间脱去一个水分子形成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
将4.3gNa,Na2O,Na2O2的混合物与足量水反应,在标准状况下得到672ml混合气体将该混合气体通过放电恰好反应,则原混合物中Na、Na2O、Na2O2的物质的量之比
A.1:2:1 B.1:1:1 C.1:3:1 D.4:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1表示KNO3的溶解度曲线,图中a点所示溶液是80℃时KNO3的不饱和溶液 | |
| B. | 图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. | 图3表示反应aA(g)+bB(g)?cC(g)表示改变某一条件对化学平衡的影响,若p1>p2 此反应自发进行,必须满足的条件是低温 | |
| D. | 图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com