
分析 (1)周期数≤最外层电子数的元素为金属元素(H元素除外),1-18号元素中金属Na的金属性最强,与氧气反应得到氧化钠、过氧化钠;
(2)1-18号元素中,He、Ne、Ar为稀有气体元素;
(3)同周期从左到右原子半径逐渐减小;
(4)有机化合物的种类最多;
(5)非金属性越强,气态氢化物越稳定.
解答 解:(1)周期数≤最外层电子数的元素为金属元素(H元素除外),1-18号元素中,Li、Be、Na、Mg、Al为金属元素,共5种元素,金属性最强的为Na,与氧气反应生成的化合物有:Na2O、Na2O2,
故答案为:5;Na2O;Na2O2;
(2)1-18号元素中,三个周期各有一种稀有气体,分别为He、Ne、Ar,故答案为:He、Ne、Ar;
(3)有机化合物的种类最多,主要含C、H元素,故答案为:C、H;
(4)同周期从左到右原子半径逐渐减小,所以最左边的钠的原子半径最大,故答案为:Na;
(5)非金属性越强,气态氢化物越稳定,非金属性N>Si,则稳定性为NH3>SiH4,故答案为:NH3;SiH4.
点评 本题考查元素周期表的结构及应用,侧重元素在周期表的位置及元素周期律的考查,注意掌握元素周期表的结构,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 | |
| B. | 根据相对分子质量的大小将共价化合物分为小分子化合物和高分子化合物 | |
| C. | 根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质 | |
| D. | 依据组成元素的种类,将纯净物分为单质和化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁(易被空气中氧气氧化)反应制得:2CH3CH(OH)COOH+FeCO3→[CH3CH(OH)COO]2Fe+CO2↑+H2O.
乳酸亚铁晶体([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是常用的补铁剂.乳酸亚铁可由乳酸与碳酸亚铁(易被空气中氧气氧化)反应制得:2CH3CH(OH)COOH+FeCO3→[CH3CH(OH)COO]2Fe+CO2↑+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )
近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(结构简式如图)是这种饮料的主要酸性物质.下列相关说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 1mol苹果酸和足量的钠反应生成1.5moL的H2 | |
| D. | 1mol苹果酸与Na2CO3溶液反应必需消耗2mol Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
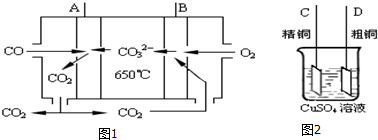
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.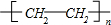 (或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).
(或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com