
| A. | 根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 | |
| B. | 根据相对分子质量的大小将共价化合物分为小分子化合物和高分子化合物 | |
| C. | 根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质 | |
| D. | 依据组成元素的种类,将纯净物分为单质和化合物 |
分析 A、最外层电子数少的不一定是金属元素;
B、相对分子质量大于10000的属于高分子化合物;
C、根据电解质能否完全电离分为强电解质和弱电解质;
D、单质和化合物区别是否由同种元素组成;
解答 解:A、氢原子最外层只有一个电子和金属钠一样,但不是金属元素,属于非金属元素,故A错误;
B、相对分子质量大于10000的属于高分子化合物,小于10000的属于小分子化合物,故B正确;
C、强电解质在溶液中完全电离,弱电解质在溶液中部分电离,根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质,故C正确;
D、单质是由同种元素组成的纯净物,化合物是由不同元素组成的纯净物,它们的区别在于是否由同种元素组成,依据组成元素的种类,将纯净物分为单质和化合物,故D正确;故选A.
点评 本题主要考查的是物质的分类,涉及强电解质和弱电解质、金属与非金属、高分子与小分子等,注重基础知识的考查,题目较简单.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 4 s内,v(B)=0.075 mol/(L•s) | |
| B. | 4 s后平衡状态下,c(A):c(C)=2:1 | |
| C. | 达到平衡状态时,若只升高温度,则C的物质的量浓度增大 | |
| D. | 达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
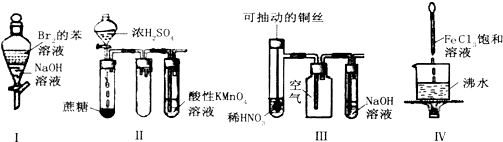
| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中无明显现象 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在能使石蕊试纸变蓝色的溶液中:Na+,AlO2-,S2-,SO42- | |
| B. | 由水电离的H+浓度c(H+)=10-12mol•L-1的溶液中:Cl-,CO32-,NH4+,SO32- | |
| C. | 在加入铝粉能产生H2的溶液中:NH4 +、Na+、Fe2+、NO3- | |
| D. | pH=2的溶液中:Na+、SO42-、NO3 -、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时电池反应为FePO4+Li=LiFePO4 | |
| B. | 充电时动力电池上标注“+”的电极应与外接电源的正极相连 | |
| C. | 放电时电池内部Li+向负极移动 | |
| D. | 所用的电解质(溶液)为水(溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和等体积、等物质的量浓度盐酸和醋酸溶液,盐酸所需NaOH溶液多于醋酸 | |
| B. | 常温下,20 LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | |
| C. | 向0.1 mol/LCH3COOH溶液中加入少量CH3COONa固 体,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 增大 | |
| D. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com