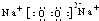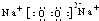(2012?西安一模)某化学学习小组对铝与酸和碱的反应进行探究,过程如下.
实验I:
(1)取形状、大小均相同的铝丝分别与等体积的、PH相同的盐酸、稀硫酸反应,随反应进行,盐酸中生成气体的速率明显比硫酸中生成气体的速率快,对此原因,你认为合理的猜测是下列的
bc
bc
(填写相应的字母);
a.盐酸的物质的量浓度大于硫酸的物质的量浓度
b.Cl
-能促进此反应的进行
c.SO
42-能抑制此反应的进行
d.硫酸使铝发生钝化
(2)为了探究反应速率不同的原因,请你根据所提供的药品,填写实验方案中的空白部分.
药品:氯化钠固体、硫酸钠固体、硫酸铜固体、氯化铜固体、6mol/L盐酸、3mol/L硫酸、18.4mol/L硫酸、5mol/L硝酸.
方案:取两支试管,分别加入形状、大小均相同的铝丝和等体积的
3mol/LH2SO4
3mol/LH2SO4
(填写相应的试剂,下同),再向其中的一支试管中加入适量的
氯化钠固体(或6mol/LHCl、硫酸钠固体)
氯化钠固体(或6mol/LHCl、硫酸钠固体)
固体,并振荡使固体溶解,观察实验现象.
实验探究:略.
实验II:
取足量的形状、质量均相同的铝丝分别与等体积的6mol/L的盐酸、6mol/L氢氧化钠溶液反应,待反应停止后取出剩余的铝丝洗净、干燥、称量,剩余铝丝的质量关系是前者
大于
大于
后者(填“大于”或“小于”或“等于”);观察反应后的液体,发现铝与盐酸反应后所得的液体是黑色浑浊的,试管底部有少量黑色沉淀,对此现象,同学们进行了如下探究:
(1)提出猜想
同学们查找资料后获得如下信息:工业上用电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,所以得到的氧化铝中可能还含有微量的氧化铁和二氧化硅两种杂质,据此,同学们提出如下猜想:
猜想1:此黑色固体是铁单质,可能是电解得到的铝与杂质反应生成的,相应的化学反应方程式为
;
猜想2:此黑色固体是硅单质,是电解得到的铝与二氧化硅反应生成的.
猜想3:此黑色固体是铝单质,是铝与盐酸反应时因反应过快而变成粉末分散到溶液中;
猜想4:此黑色固体可能是上述若干种单质组成的混合物.
(2)设计实验方案并完成相关实验:
将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中,完成下列实验:
1向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解.实验时发现固体完全溶解,证明猜想
2
2
一定不正确(填“1”、“2”、“3”、“4”).
②向另一试管中加入足量的氢氧化钠溶液,观察固体是否溶解.实验时发现固体完全溶解,证明猜想
1
1
一定不正确(填“1”、“2”、“3”、“4”);
(3)得出结论
综合实验①②的现象,可推知猜想
3
3
(填“1”、“2”、“3”、“4”)是正确的,固体溶解在氢氧化钠溶液中的离子方程式为:
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.

 阅读快车系列答案
阅读快车系列答案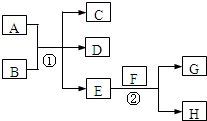 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略),请回答下列问题: