
 (2013?安徽)一定条件下,通过下列反应可以制备特种陶瓷的原料MgO: (2013?安徽)一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
|


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
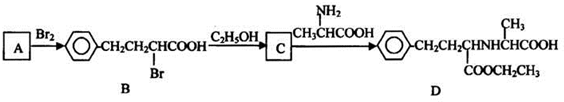
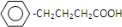
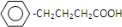
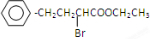
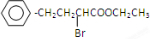
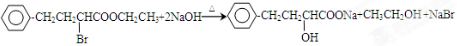

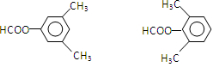
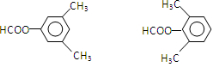
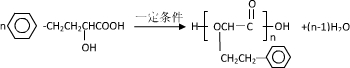

查看答案和解析>>
科目:高中化学 来源: 题型:
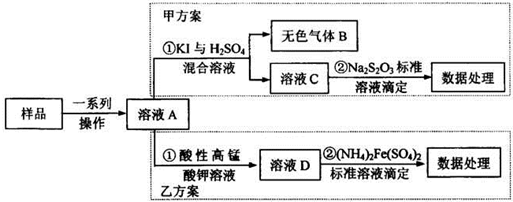
| 690 |
| a |
| 690 |
| a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com