
【题目】(1)为清理路面积雪人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。该融雪剂的化学式是____________,该物质中化学键类型是___________,电子式是_________。
(2)已知A、B、C、D是中学化学中常见的四种不同粒子.它们之间存在如图所示的转化关系.
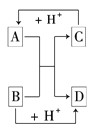
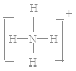
如果A、B、C、D均是10电子的粒子,请写出:A的结构式________,D的电子式________.
(3)下列说法正确的是 (填写字母序号) ____________
A.晶体中分子间作用力越大,分子越稳定
B. 分子晶体的熔沸点比较低
C.冰融化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未破坏
E.在离子化合物里,只存在离子键,没有共价键
F.任何分子中一定都存在化学键
G.在共价化合物分子内,一定不存在离子键
H.全部由非金属元素形成的化合物中不可能含有离子键
(4)下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ______
A.NaOH和NaCl B.CO2和H2
C.NaCl和HCl D.CCl4和KCl
【答案】 CaCl2 离子键 ![]()
![]() B G B
B G B
【解析】试题分析:XY2的阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子,所以X2+、Y-,都是18电子微粒,所以X是Ca元素、Y是Cl元素。
如果A、B、C、D均是10电子的粒子,结合10电子微粒进行分析判断;根据发生反应A+B=C+D,A、B、C、D均是10电子的粒子,可判断为:A、B分别为OH-、NH4+,C、D分别为NH3、H2O。又因为B和氢离子反应生成D,所以B是OH-,D是水,A是NH4+,C是氨气。
解析:(1)XY2的阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子,所以X2+、Y-,都是18电子微粒,所以X是Ca元素、Y是Cl元素,该融雪剂的化学式是CaCl2,CaCl2是离子化合物,化学键类型是离子键,电子式是![]() ;根据(2) NH4+的结构式
;根据(2) NH4+的结构式 ,H2O的电子式
,H2O的电子式![]() ;
;
(3)A.键能越大分子越稳定,化学键决定分子越稳定性,故A错误;B. 分子间作用力越大,分子晶体的熔沸点越高,故B正确;C.冰融化时分子间作用力被破坏,故C错误;D.氯化钠熔化时破坏离子键,故D错误;E.在离子化合物里,存在离子键,可能有共价键,故E错误;F.稀有气体没有化学键,故F错误;G.在共价化合物,只含有共价键,故G正确;H.全部由非金属元素形成的化合物氯化铵中含有离子键,故H错误。
(4)NaOH属于离子晶体,含有离子键、共价键; NaCl 属于离子晶体,含有离子键,故A错误; CO2属于分子晶体,含有共价键; H2 属于分子晶体,含有共价键,故B正确;NaCl 属于离子晶体,含有离子键;HCl属于分子晶体,含有共价键,故C错误;CCl4属于分子晶体,含有共价键;KCl属于离子晶体,含有离子键,故D错误;


科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)甲同学在a、b、c三只烧杯里分别加入50 mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾粒,观察现象。
甲同学设计实验的目的是_____________________________________。反应最剧烈的烧杯是________(填序号)。
(Ⅱ)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性越强。他设计了右图所示装置以验证氮、碳、硅元素的非金属性强弱。
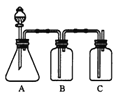
(1)已知仪器A中放一种块状固体,打开分液漏斗的活塞后,A中可观察到的现象是___________;C中可观察到的现象是_____________。
(2)仪器B盛放的试剂是______________________,其作用是_________________。
(3)分别写出A、B、C中发生反应的离子方程式______________、_______________、________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 往硝酸银溶液中滴加少量氨水:Ag++2NH3═[Ag(NH3)2]+
B. 尼泊金酸(![]() )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应:![]()
C. 乙醛的银镜反应:CH3CHO+2[Ag(NH3)2]++2OH﹣![]() CH3COO﹣+NH4++2Ag↓+3NH3+H2O
CH3COO﹣+NH4++2Ag↓+3NH3+H2O
D. 苯酚钠溶液中通入CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定浓度的下列溶液,不外加任何试剂就能依次鉴别出来,正确的鉴别顺序为
① NaOH溶液 ② (NH4)2SO4溶液 ③ BaCl2溶液 ④ KNO3溶液 ⑤ FeCl3溶液
A.①②③④⑤ B.②③⑤④① C.⑤①②③④ D.⑤③②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A、分散质粒子的直径为纳米级者(1nm~100nm)的分散系是胶体。
B、胶体可通过过滤的方法从溶液中分离出来。
C、氢氧化铁胶体可以稳定存在的原因是胶粒带正电荷。
D、利用丁达尔现象可以区别溶液与胶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与其主要成分的化学式相对应的是
A. 铝热剂-Al B. 明矾-KAl(SO4)2 C. 纯碱-Na2CO3 D. 葡萄糖-C6H12O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表符号中“2”的含义正确的一组是( )
2H | 2He | 2Cl | Ca2+ | |
A | 质量数 | 中子数 | 质子数 | 电荷数 |
B | 质量数 | 质子数 | 原子个数 | 电荷数 |
C | 质子数 | 中子数 | 原子个数 | 电荷数 |
D | 质量数 | 质子数 | 中子数 | 电荷数 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出XH3的电子式:_________________,由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物的化学式为_________
(2)用电子式表示Y2O的形成过程:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组的同学利用下图所示装置进行某些气体的制备、性质等实验(图中夹持装置有省略)
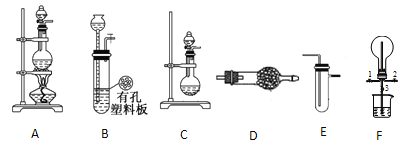
请回答下列问题:
(1)根据上述实验装置,用MnO2和浓盐酸制备纯净、干燥的Cl2,可选用的发生、净化装置连接顺序为 →E→接E,第一个E装置的药品是 。
(2)根据上述实验装置,为制备干燥NH3,可选用的发生、净化装置为 接 。其中发生装置中可以选用的药品为 (填选项字母)
a.碱石灰和浓氨水 b.浓H2SO4和浓氨水 c.碱石灰和氯化铵 d.生石灰和氯化铵
(3)一定条件下,Cl2 与CH4在装置F中发生反应,其有机物有 。(填化学式)
(4)利用装置F可探究Cl2和NH3的反应。
已知Cl2与NH3可发生反应:3Cl+2NH3=N2+6HCl,实验时打开开关1、3,关闭2,先向烧瓶中通入Cl2,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的NH3。
①不能先通入NH3的原因: 。
②试验一段时间后烧瓶内出现的现象为: 。
③装置F中烧杯内发生反应的离子方程式为: 。
④请设计一个实验方案(操作过程、实验现象)鉴定烧瓶内最终固体产物的阳离子,其方案为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com